��Ŀ����
����Ŀ�������ѣ�Ti��Ӳ�ȴ��۵�ߡ���ʴ������Ϊ��δ��������������������Ҫ�ɷ�ΪFeTiO3��������һϵ�з�Ӧ�Ʊ��Ѻ�����TiO2����Ҫ����������ͼ������Ӧ�IJ�������������ȥ�� 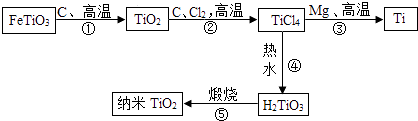
��1������������FeTiO3������Ԫ�صĻ��ϼ�Ϊ�ۣ�
��2����Ӧ������TiCl4��һ���ж������壬��������һ��������仯ѧʽΪ��
��3����Ӧ�������û���Ӧ��д���÷�Ӧ�Ļ�ѧ����ʽ����
��4�����������еķ�Ӧ�����ǷֽⷴӦ����������ţ���
��5�������������õ������TiO2�ķ������Ʊ������ѻ�óɹ����������ĽǶȷ�������ҵ�����ø÷����Ʊ��ѵ���Ҫȱ���� ��
���𰸡�
��1��+4
��2��CO
��3��2Mg+TiCl4 ![]() ?2MgCl2+Ti
?2MgCl2+Ti
��4����
��5�����Ĵ����ĵ���
���������⣺��1���ڻ�ѧFeTiO3�У�������Ԫ�ػ��ϼ۵Ĵ�����Ϊ0�������ѵĻ��ϼ�Ϊ0����+2��������2����3=+4����2������TiO2��C��Cl2��Ӧ������TiCl4��һ���ж������壬��������һ��������������غ㶨�ɿ�֪�������ʺ���̼Ԫ�غ���Ԫ�أ�Ӧ��һ����̼���仯ѧʽΪ��CO����3��TiCl4�ڸ�����������Mg��Ӧ���ɽ���Ti�����������غ㶨�ɿ�֪����Ӧ���Ȼ�þ�����Է���ʽ�ǣ�2Mg+TiCl4 ![]() 2MgCl2+Ti����4���ɷ�Ӧ�����̿�֪��H2TiO3����������TiO2��ˮ�����ڷֽⷴӦ����5���������TiO2�ķ������Ʊ���������Ҫ���Ĵ����ĵ��ܣ����ǹ�ҵ���Ʊ��ѵ���Ҫȱ�㣮 �ʴ�Ϊ����1��+4����2��CO����3��2Mg+TiCl4
2MgCl2+Ti����4���ɷ�Ӧ�����̿�֪��H2TiO3����������TiO2��ˮ�����ڷֽⷴӦ����5���������TiO2�ķ������Ʊ���������Ҫ���Ĵ����ĵ��ܣ����ǹ�ҵ���Ʊ��ѵ���Ҫȱ�㣮 �ʴ�Ϊ����1��+4����2��CO����3��2Mg+TiCl4 ![]() 2MgCl2+Ti����4���ݣ���5�����Ĵ����ĵ��ܣ�
2MgCl2+Ti����4���ݣ���5�����Ĵ����ĵ��ܣ�
�����㾫����������Ҫ�����˷ֽⷴӦ����Ӧ�ú������غ㶨�ɼ���Ӧ�õ����֪ʶ�㣬��Ҫ���շֽⷴӦ����һ�ַ�Ӧ���������ֻ����������������ʵķ�Ӧ���������غ㶨��ֻ�����ڻ�ѧ�仯���������������仯���ڲ��μӷ�Ӧ����������������������������������ܼ��롰�ܺ͡��У���Ҫ���ǿ����е������Ƿ�μӷ�Ӧ�����ʣ������壩������©������ȷ�����⣮

 �����Ļ���������人������ϵ�д�
�����Ļ���������人������ϵ�д� ���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�
���������ּ���ÿһ��ȫ�º�����ҵ��ϵ�д�