题目内容
【题目】根据如图所示实验,回答下列问题。
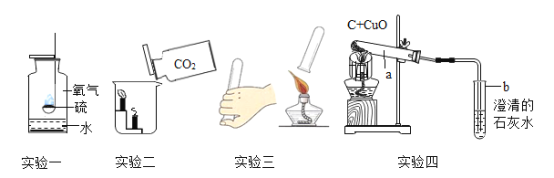
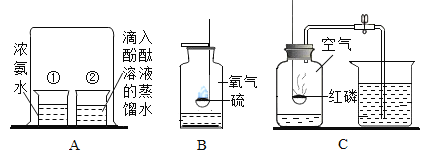
(1)实验一:集气瓶底部水的作用是_________。
(2)实验二:倾倒二氧化碳时观察到的现象是________。此现象说明二氧化碳的化学性质是______。
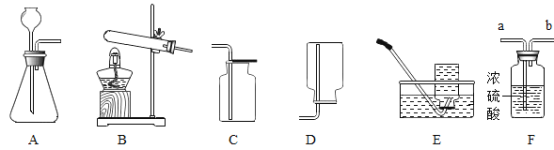
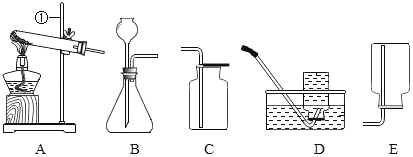
(3)实验三:试管中装有氢气,该操作的目的是________________。
(4)实验四:试管a中的黑色粉末变成________________色。写出试管a中发生反应的化学方程式________________。
【答案】吸收二氧化硫,防止污染空气 烧杯中燃着的蜡烛从下到上依次熄灭 不能燃烧也不支持燃烧 检验氢气纯度,防止氢气中混有空气,达到爆炸极限,而发生爆炸 红 ![]()
【解析】
(1)硫在氧气中燃烧产生有刺激性气味,污染空气的二氧化硫,二氧化硫易溶于水,因此,集气瓶底部水的作用是吸收有害气体二氧化硫,防止污染空气;
(2)由于二氧化碳不可燃,也不支持燃烧,且密度比空气大,所以如图向烧杯内倾倒二氧化碳时,下面的蜡烛先熄灭,然后上面的蜡烛才熄灭,故填写:烧杯中燃着的蜡烛从下到上依次熄灭;
该实验说明二氧化碳具有不能燃烧也不支持燃烧的化学性质,故填写:不能燃烧也不支持燃烧;
(3)由图可知,该实验是检验氢气纯度的实验,目的是防止氢气中混有空气,达到爆炸极限,而发生爆炸;
(4)由图可知,实验四的试管a中,反应物是碳和氧化铜,高温条件下发生反应,观察到黑色粉末变为红色,故填写:红;
(5)碳和氧化铜在高温下生成铜和二氧化碳,故填写:![]() 。
。

【题目】为测定某石灰石矿中碳酸钙的含量,兴趣小组同学称取12.5g石灰石矿样品粉末于烧杯中,将80 g稀盐酸分四次加入,充分反应,测得实验数据如下表所示(杂质不溶于水,也不参与反应,生成的气体全部逸出):
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀盐酸的质量(g) | 20 | 20 | 20 | 20 |
烧杯中剩余物的质量(g) | 30.5 | 48.5 | 68.1 | 88.1 |
(1)样品完全反应生成二氧化碳的总质量为多少g。
(2)计算该石灰石矿中碳酸钙的质量分数。