题目内容
【题目】X、Y、Z、L、M 五种元素的原子序数依次增大.X、Y、Z、L 是组成蛋白质的基础元素,M 是地壳中含量最高的金属元素.回答下列问题:
(1)五种元素的原子半径从大到小的顺序是______(用元素符号表示).
(2)X 与 Z 形成的 3:1 的化合物 A,它与 Z 的最高价氧化物对应的水化物 B 反应的化学方程式________ ,该水溶液显________ 性,用离子方程式解释原 因_______.
(3)硒是人体必需的微量元素,与 L 同一主族,其最高价氧化物对应的水化物 化学式为_______ .该元素固体单质与 H2 反应生成 0.5mol 气态氢化物时吸收了14.87kJ 的热量,请写出 1mol 该物质与氢气化合的热化学方程式_______.
(4)用 M 单质作阳极,石墨作阴极,NaHCO3 溶液作电解液进行电解,生成难溶物 R,R 受热分解生成化合物 Q.写出阳极生成 R 的电极反应式:_______;由 R 生成 Q 的化学方程式:_______.
【答案】Al>C>N>O>H NH3+HNO3=NH4NO3 酸 NH4++H2ONH3![]() H2O+H+ H2SeO4 Se(s)+H2(g)=H2Se(g),△H=+29.74 kJ /mol Al-3e-+3HCO3-═Al(OH)3↓+3CO2↑ 2Al(OH)3
H2O+H+ H2SeO4 Se(s)+H2(g)=H2Se(g),△H=+29.74 kJ /mol Al-3e-+3HCO3-═Al(OH)3↓+3CO2↑ 2Al(OH)3 ![]() Al2O3+3H2O
Al2O3+3H2O
【解析】
组成蛋白质的基础元素是碳、氮、氧、氢,H 的原子半径最小,地壳中含量最高的金属元素是铝元素,X、Y、Z、L、M 五种元素的原子序数依次增大,所以 X 是氢、Y 是碳,Z 是氮、L 是氧、M 是铝。
由分析可知(1)H的原子半径最小,C、N、O位于同一周期,原子半径大小顺序为C>N>O,同主族自上而下原子半径增大,则Al的原子半径最大,则有Al>C>N>O>H;
(2)X 是氢,Z 是氮,所以 X 与 Z 形成的 3:1 的化合物 A 是 NH3,Z 的最高价的氧化物的水化物是硝酸,氨气和硝酸反应生成硝酸铵,反应的化学方程式:NH3+HNO3=NH4NO3;硝酸铵在水溶液中的铵根离子和水电离出来的氢氧根离子结合成氨水,所以溶液呈酸性;离子方程式NH4++H2ONH3![]() H2O+H+;
H2O+H+;
(3)硒(Se)是人体必需的微量元素,与O同一主族,硒元素的最高化合价为+6 价其最高价氧化物对应的水化物化学式为H2SeO4;该元素固体单质与 H2 反应生成 0.5mol 气态
氢化物时吸收了 14.87kJ 的热量,生成 1mol 态氢化物时吸收了29.74 kJ,反应热化学方程式为:Se(s)+H2(g)=H2Se(g)△H=+29.74 kJ /mol;
(4)用Al单质作阳极,石墨作阴极,NaHCO3溶液作电解液进行电解,生成难溶物R,为氢氧化铝,氢氧化铝受热分解生成化合物Q为氧化铝,阳极生成氢氧化铝,同时生成二氧化碳,阳极电极反应式为:Al-3e-+3HCO3-═Al(OH)3↓+3CO2↑;由R生成Q的化学方程式为:2Al(OH)3 ![]() Al2O3+3H2O。
Al2O3+3H2O。

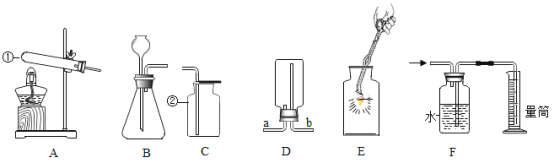
【题目】为研究化学反应前后反应物与生成物之间的质量关系,做了下列三个实验。
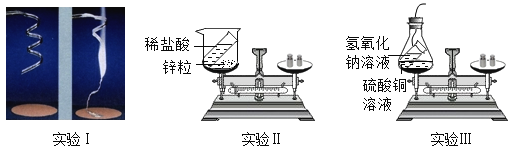
实验Ⅰ:称量镁条,点燃,待反应结束后,再称量。实验Ⅱ:将盛有稀盐酸的小试管放入装有锌粒的烧杯中,称量,然后将稀盐酸与锌粒接触,过一会儿再称量。实验Ⅲ:将装有氢氧化钠溶液的试管放入盛有硫酸铜溶液的烧杯中,称量,然后设法将两种溶液接触(有蓝色氢氧化铜沉淀和硫酸钠生成),过一会儿再称量。数据见下表:
编号 | 实验Ⅰ | 实验Ⅱ | 实验Ⅲ |
反应前 | 4.8g | 112.6g | 118.4g |
反应后 | 6.0g | 112.4g | 118.4g |
(1)从表面上看,这三个实验中,发生化学反应前后物质的质量:实验Ⅰ_____;实验Ⅱ_____;实验Ⅲ_____。(填“增大”、“减小”或“不变”)
(2)造成此结果的原因可能是_____。
(3)这三个实验中,实验_____正确地反映了反应物与生成物之间的质量关系。
(4)从不能正确反映反应物与生成物之间质量关系的实验中,选一例说明实验设计的不恰当之处,并提出改进思路:_____。
(5)由此可得出,在做实验研究化学反应前后反应物与生成物之间的质量关系时,必须在_____体系中进行。