题目内容
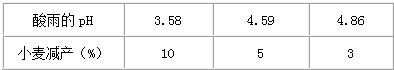
18、酸雨是指pH<5.6的雨、雪等各种形式的大气降水.它主要是由含硫燃料(煤和石油)燃烧和金属冶炼厂释放的二氧化硫气体造成.酸雨的危害极大,减少二氧化硫等污染物的排放,保护环境是非常重要的.某校化学兴趣小组的学生,取刚降到地面的酸雨水样,每隔一定时间测定其pH,数据如下表所示.不同时间酸雨的pH

(1)从测定的数据可知:在测定的40分钟内酸雨水样的酸性是
(2)在测定的时间内,酸雨水样pH发生变化的主要原因是:排放到空气中的二氧化硫与雨水作用生成的亚硫酸(H2SO3),降落到地面后,亚硫酸在空气中被氧气逐渐氧化生成酸性更强的硫酸(H2SO4)的缘故.请写出这一过程的两个化学方程式:

(1)从测定的数据可知:在测定的40分钟内酸雨水样的酸性是
增强
(填“增强”或“减弱”)(2)在测定的时间内,酸雨水样pH发生变化的主要原因是:排放到空气中的二氧化硫与雨水作用生成的亚硫酸(H2SO3),降落到地面后,亚硫酸在空气中被氧气逐渐氧化生成酸性更强的硫酸(H2SO4)的缘故.请写出这一过程的两个化学方程式:
SO2+H2O═H2SO3、2H2SO3+O2═2H2SO4
.分析:当溶液的PH<7时,随着PH的减小酸性增强.可以根据反应物和生成物及其质量守恒定律可以正确的书写化学方程式.
解答:解:(1)在测定的40分钟内雨水的PH是减小的,酸性增强.故填:增强.
(2)二氧化硫与雨水作用生成的亚硫酸(H2SO3),亚硫酸在空气中被氧气逐渐氧化生成酸性更强的硫酸(H2SO4).这一过程的两个化学方程式为:SO2+H2O═H2SO3;2H2SO3+O2═2H2SO4
(2)二氧化硫与雨水作用生成的亚硫酸(H2SO3),亚硫酸在空气中被氧气逐渐氧化生成酸性更强的硫酸(H2SO4).这一过程的两个化学方程式为:SO2+H2O═H2SO3;2H2SO3+O2═2H2SO4
点评:解答本题的关键是要掌握溶液的酸碱性与溶液PH的关系、物质之间相互作用时的实验现象及其书写化学方程式的方法,只有这样才能对问题做出正确的判断..

练习册系列答案
相关题目