题目内容
【题目】下列关于图像的描述正确的是( )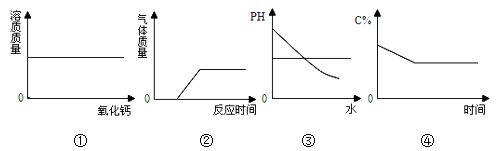
A.图①表示室温下向饱和石灰水中加入一定量氧化钙,并恢复至室温
B.图②表示把一片长时间暴露在空气中的铝箔投入到过量的稀盐酸中
C.图③表示向氢氧化钠溶液中加入大量的水
D.图④表示将饱和硝酸钾溶液恒温蒸发水份(C%表示溶液的溶质质量分数)
【答案】B
【解析】A、室温下向饱和石灰水中加入一定量氧化钙,并恢复至室温,则氧化钙与水反应消耗了溶剂水,故会有氢氧化钙析出,溶质质量减小,A不符合题意;
B、把布满锈迹的铁钉投入到过量的稀硫酸中,则是先氧化铁能与盐酸反应生成氯化铁和水,后铁能与盐酸反应产生氢气,是过一段时间产生气体,B符合题意;
C、向氢氧化钠溶液中加入大量的水,氢氧化钠溶液加水稀释pH会减小,但是不会小于7,C不符合题意;
D、饱和硝酸钾溶液恒温蒸发水分其溶质质量分数不变,D不符合题意。
所以答案是:B。
【考点精析】本题主要考查了饱和溶液和不饱和溶液的相关知识点,需要掌握饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解才能正确解答此题.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组的同学在做氢氧化钙与盐酸中和反应的实验时,忘记滴加指示剂,因而无法判断酸碱是否恰好完全反应。于是他们对反应后溶液中的溶质大胆提出猜想,进行了以下探究,请你和他们一起完成下列实验报告。
Ⅰ.定性探究
【提出问题】该溶液中的溶质含有哪些成分?
【查阅资料】CaCl2溶液呈中性。
(1)【猜想与假设】
猜想Ⅰ:溶液中的溶质只有;
猜想Ⅱ:溶液中的溶质有CaCl2、HCl;
猜想Ⅲ:溶液中的溶质有CaCl2、Ca(OH)2;
猜想Ⅳ:溶液中的溶质有CaCl2、Ca(OH)2、HCl。
(2)经过讨论,同学们直接得出不合理的猜想是哪一种并说出理由:。
为了验证余下的哪一种猜想是正确的,同学们又做了以下实验。
(3)【进行实验】研究
实验操作 | 实验现象 | 实验结论 |
①取少量反应后的溶液于试管中,滴加酚酞溶液 | 溶液不变色 | 猜想Ⅲ不正确 |
②再另取少量反应后的溶液于另一支试管中,向里面加入适量碳酸钠 | 有气泡产生 | 猜想正确 |
(4)操作②有气泡生成的化学方程式为。
(5)下列曲线能够表示所做实验中溶液pH变化趋势的是 (填序号)。
A.滴加盐酸的质量 
B.滴加盐酸的质量 
C.滴加盐酸的质量 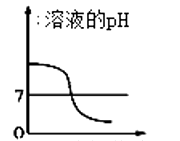
D.滴加盐酸的质量 
(6)【反思交流】
要使烧杯内溶液的溶质只含CaCl2 , 需要除去杂质,其中的一种方法是向烧杯中加入过量的 , 然后过滤。
(7)Ⅱ.定量探究
兴趣小组同学想对本地化工厂排放废水中的HCl含量进行了测定(不含其他酸性物质)。取废水5 g,用质量分数为2%的氢氧化钙溶液进行中和,如下图所示。请你计算废水中HCl的质量分数。(写出具体的计算过程)