题目内容
氧化钠能与水发生如下反应:Na2O+H2O=2NaOH.现将质量为m的水加到6.2克氧化钠中,完全反应后,得到溶质的质量分数为16%的溶液.试求:(1)6.2克的氧化钠中氧元素的质量是______克.
(2)反应后所得溶液中溶质的质量是多少?
(3)若取反应后所得溶液30克,稀释成溶质的质量分数10%的溶液,需加水多少克?
(4)加到氧化钠中水的质量m是______.
(要求写出第2小题和第3小题的解题过程)
【答案】分析:(1)先计算出氧元素的质量分数,然后计算氧元素的质量.
(2)写出化学方程式并代入氧化钠的质量计算出氢氧化钠的质量.
(3)稀释前后溶质的质量保持不变.
(4)先算出溶液中的水的质量,然后计算出参加反应的水的质量,两者之和就是m的大小.
解答:解:(1)氧化钠中氧元素的质量分数=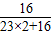 ×100%═25.8%,则氧元素的质量=6.2克×25.8%=1.6克.故答案为:1.6.
×100%═25.8%,则氧元素的质量=6.2克×25.8%=1.6克.故答案为:1.6.
(2)解:设反应生成的氢氧化钠的质量为X,参加反应的水的质量为Y.
Na2O+H2O=2NaOH
62 18 80
6.2克 Y X
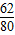 ═
═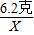
得:X=8克
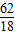 ═
═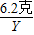
得:Y=1.8克
(3)设需加水的质量为M.
30克×16%=(30克+M)×10%
得:M=18克
(4)反应后溶液的质量=8克÷16%═50克,则溶剂(水)的质量=50克-8克=42克.m=42克+1.8克=43.8克,故答案为:43.8克.
点评:掌握化学方程式的计算格式和规范性,本题的易错点是(4)的水的计算,m的大小包含溶液中溶剂的质量和参加反应水的质量之和.
(2)写出化学方程式并代入氧化钠的质量计算出氢氧化钠的质量.
(3)稀释前后溶质的质量保持不变.
(4)先算出溶液中的水的质量,然后计算出参加反应的水的质量,两者之和就是m的大小.
解答:解:(1)氧化钠中氧元素的质量分数=
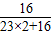 ×100%═25.8%,则氧元素的质量=6.2克×25.8%=1.6克.故答案为:1.6.
×100%═25.8%,则氧元素的质量=6.2克×25.8%=1.6克.故答案为:1.6.(2)解:设反应生成的氢氧化钠的质量为X,参加反应的水的质量为Y.
Na2O+H2O=2NaOH
62 18 80
6.2克 Y X
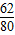 ═
═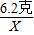
得:X=8克
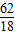 ═
═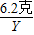
得:Y=1.8克
(3)设需加水的质量为M.
30克×16%=(30克+M)×10%
得:M=18克
(4)反应后溶液的质量=8克÷16%═50克,则溶剂(水)的质量=50克-8克=42克.m=42克+1.8克=43.8克,故答案为:43.8克.
点评:掌握化学方程式的计算格式和规范性,本题的易错点是(4)的水的计算,m的大小包含溶液中溶剂的质量和参加反应水的质量之和.

练习册系列答案
 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案
相关题目