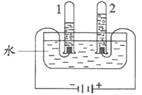
题目内容
【题目】下列说法正确的是( )
A.同种元素质子数相同,所以质子数相同的粒子是同一种元素。
B.燃烧都伴随着发光、放热, 所以有发光、放热现象的一定是燃烧
C.化合物至少由两种元素组成, 所以由两种元素组成的纯净物一定是化合物
D.对于由分子构成的物质,分子是保持其物理性质的基本微粒。
【答案】C
【解析】
A.质子数相同的粒子不一定是原子,可能是分子、离子,例如质子数为10的粒子有:水分子、氖原子等,故错误;
B.有发光放热现象的变化不一定是燃烧,如通电的电灯,故错误;
C.化合物至少由两种元素组成, 所以由两种元素组成的纯净物一定是化合物,故正确;
D. 对于由分子构成的物质,分子是保持其化学性质的基本微粒,故错误。
故选:C。

【题目】化学兴趣小组为验证质量守恒定律,做了镁条在空气中燃烧的实验。同学们观察到镁条在空气中剧烈燃烧,发出耀眼的强光,产生的大量白烟弥漫到空气中,最后在石棉网上得到一些白色固体。
(1)请写出镁条燃烧的化学方程式______________________________。
(2)同学们通过称量发现:在石棉网上收集到产物的质量小于镁条的质量。有人认为这个反应不遵循质量守恒定律。你认为出现这样实验结果的原因可能是:____________________。
(3)小红按下图装置改进实验,验证了质量守恒定律,还发现产物中有少量黄色固体。
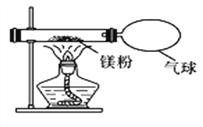
【提出问题】黄色固体是什么?
【查阅资料】①氧化镁为白色固体;②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体;③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
【做出猜想】黄色固体是Mg3N2
实验操作 | 实验现象及结论 |
_______________________ | ____________________ |
【实验探究】请设计实验,验证猜想(上表)。
【反思与交流】空气中N2的含量远大于O2的含量,可是镁条在空气中燃烧产物MgO却远多于Mg3N2,合理的解释是:_______________________ 。
【题目】某课外小组,用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应).甲、乙、丙三同学分别进行实验,实验数据如下(烧杯的质量为25.0g).
烧杯+盐酸 | 大理石 | 充分反应后烧杯+剩余物 | |
甲 | 75.0g | 13.2g | 83.8g |
乙 | 75.0g | 16.0g | 86.6g |
丙 | 95.0g | 13.2g | 103.8g |
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
(1) 同学所取的盐酸与大理石恰好完全反应.
(2)计算大理石中碳酸钙的质量分数(计算结果精确到0.1%).