题目内容
 (2013?淮安)某同学称取一定质量的铁粉样品(含有少量不与稀硫酸反应的杂质),放入烧杯中,加入98g稀硫酸,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:
(2013?淮安)某同学称取一定质量的铁粉样品(含有少量不与稀硫酸反应的杂质),放入烧杯中,加入98g稀硫酸,恰好完全反应,生成气体的质量与反应时间的关系如图所示,试回答下列问题:(1)根据图象,恰好完全反应时生成氢气的质量是
0.2
0.2
g;(2)样品中铁的质量是多少?稀硫酸的溶质质量分数是多少?(写出计算过程)
分析:(1)从图象可直接读出最终生成氢气的质量;
(2)利用氢气的质量可求出反应的铁和硫酸的质量,而后根据问题计算即可解答;
(2)利用氢气的质量可求出反应的铁和硫酸的质量,而后根据问题计算即可解答;
解答:解:(1)由图象可知最终生成氢气的质量是0.2g;
(2)设样品中铁的质量是x,反应的硫酸的质量是y
Fe+H2SO4 ═FeSO4+H2↑
56 98 2
x y 0.2g
=
=
x=5.6g y=9.8g
故稀硫酸的溶质质量分数为
×100%=10%
故答案为:(1)0.2;(2)样品中铁的质量是5.6g,稀硫酸的溶质质量分数是10%;
(2)设样品中铁的质量是x,反应的硫酸的质量是y
Fe+H2SO4 ═FeSO4+H2↑
56 98 2
x y 0.2g
| 56 |
| x |
| 98 |
| y |
| 2 |
| 0.2g |
x=5.6g y=9.8g
故稀硫酸的溶质质量分数为
| 9.8g |
| 98g |
故答案为:(1)0.2;(2)样品中铁的质量是5.6g,稀硫酸的溶质质量分数是10%;
点评:解答此类问题的根本点在于对反应图象的曲线进行分析,曲线的折点表示此时恰好完全反应.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目

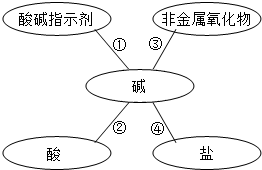 (2013?淮安)某化学兴趣小组学习酸、碱、盐性质后,通过实验对碱的化学性质进行验证和总结,如图所示(已知:CaCl2溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl).
(2013?淮安)某化学兴趣小组学习酸、碱、盐性质后,通过实验对碱的化学性质进行验证和总结,如图所示(已知:CaCl2溶液呈中性,CaCl2+Na2CO3=CaCO3↓+2NaCl).