题目内容
【题目】下列四个图形的变化趋势能正确描述对应操作的是( )
A.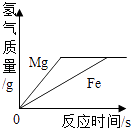 足量的铁片和镁条分别与等质量、等质量分数的稀盐酸反应
足量的铁片和镁条分别与等质量、等质量分数的稀盐酸反应
B. 将浓盐酸敞口放置在空气中
将浓盐酸敞口放置在空气中
C. 向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
向氢氧化钠和硝酸钡的混合溶液中逐滴加入稀硫酸
D.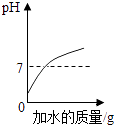 向pH=2的盐酸溶液中加水稀释
向pH=2的盐酸溶液中加水稀释
【答案】A
【解析】解:A、在金属活动性顺序中,镁和铁都排在氢的前面,可以与盐酸发生置换反应生成氢气,镁排在铁的前面,故反应速度比铁快,在图象中,斜率表示的就是反应的速度,斜率越大,反应速度越大,足量的镁与铁与相同的酸反应,生成氢气的质量相同,故正确; B、浓盐酸具有挥发性,易挥发出溶质氯化氢,导致溶质质量分数降低,而图象显示其质量分数增大,故错误;
C、硝酸钡和硫酸反应生成不溶于水的硫酸钡沉淀,一开始就会出现沉淀,而图象显示是过一段时间才出现沉淀,故错误;
D、盐酸溶液呈酸性,加水后酸性减弱,PH增大,无论怎样加水,其PH总是小于7,不会大于7,故错误,
故选A.
A、根据足量的铁与镁与相同的酸反应,生成氢气的质量相同,镁排在铁的前面,反应速度比铁快解答;
B、根据浓盐酸具有挥发性,易挥发出溶质氯化氢,导致溶质质量分数降低解答;
C、根据硝酸钡和硫酸反应生成不溶于水的硫酸钡沉淀解答;
D、根据盐酸溶液呈酸性,加水后酸性减弱,PH增大解答.

练习册系列答案
相关题目