题目内容
【题目】“生态安全环境治理”是生态文明贵阳国际论坛2014年年会的一个主题.化学在防治大气污染和水污染方面发挥了重要作用,使更多的化学生产工艺和产品向着环境友好的方向发展.
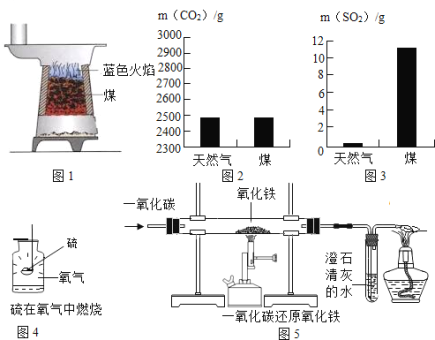
(1)根据图1,如果把煤燃烧看做是C与O2的反应,燃烧的煤炉里可能发生的化学反应共有 个.为使煤充分燃烧,合理的做法是 (写一种做法),这对于节约能源非常重要.
(2)为从源头消除污染,人们在生产、生活中选择对环境影响小的燃料.充分燃烧1kg天然气和煤所产生的二氧化碳和二氧化硫质量如图2、3所示,通过比较选择 燃烧对环境影响较小.随着科技发展,氢气将会成为主要能源之一,氢气在空气中燃烧的反应方程式为 ,请比较分析选用氢气作为能源的优点是 .
(3)火力发电厂为防止环境污染需将燃烧产生的二氧化碳进行处理,其原理是2CaCO3+2SO2+O2═2CaSO4+2 (补充完整化学反应方程式),这样可以减少酸雨的形成.
(4)造纸厂会产生大量含NaOH的碱性废水,可用 (填化学式)中和处理达标后再排放,从而防止水体污染
(5)保护环境从我做起
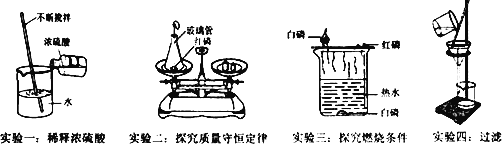
①图4实验,集气瓶里放入水量水的主要目的是 .
②图5实验,酒精灯的作用是 ,为使该套装置既达到防止空气污染又起节约资源的目的,你的改进方法是 .
【答案】(1) 4;把煤粉碎.(2) 天然气;2H2+O2![]() 2H2O;热值高,产物不污染环境.(3) CO2(4) HCl.(5) ①吸收反应生成的二氧化硫; ②:把一氧化碳转化成二氧化碳;在导管末端连接导管至酒精喷灯火焰上方.
2H2O;热值高,产物不污染环境.(3) CO2(4) HCl.(5) ①吸收反应生成的二氧化硫; ②:把一氧化碳转化成二氧化碳;在导管末端连接导管至酒精喷灯火焰上方.
【解析】
试题分析:(1)燃烧的煤炉里可能发生的化学反应共有4个,分别是碳完全燃烧生成二氧化碳,不完全燃烧生成一氧化碳,一氧化碳燃烧生成二氧化碳,二氧化碳在高温条件下和碳反应生成一氧化碳;为使煤充分燃烧,合理的做法是把煤粉碎或鼓入大量的空气.(2)由图中信息可知,充分燃烧1kg天然气和煤所产生的二氧化碳差不多,而产生的二氧化硫相差很大,天然气燃烧产生的二氧化硫较少;氢气在空气中燃烧的反应方程式为:2H2+O2![]() 2H2O,氢气作为能源的优点是热值高,产物不污染环境.(3)由质量守恒定律可知,生成物是硫酸钙和二氧化碳.(4)造纸厂会产生大量含NaOH的碱性废水,可用HCl中和处理达标后再排放,从而防止水体污染.(5)①图4实验,集气瓶里放入水量水的主要目的是吸收反应生成的二氧化硫.②图5实验,酒精灯的作用是把一氧化碳转化成二氧化碳,为使该套装置既达到防止空气污染又起节约资源的目的,你的改进方法是在导管末端连接导管至酒精喷灯火焰上方.
2H2O,氢气作为能源的优点是热值高,产物不污染环境.(3)由质量守恒定律可知,生成物是硫酸钙和二氧化碳.(4)造纸厂会产生大量含NaOH的碱性废水,可用HCl中和处理达标后再排放,从而防止水体污染.(5)①图4实验,集气瓶里放入水量水的主要目的是吸收反应生成的二氧化硫.②图5实验,酒精灯的作用是把一氧化碳转化成二氧化碳,为使该套装置既达到防止空气污染又起节约资源的目的,你的改进方法是在导管末端连接导管至酒精喷灯火焰上方.

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】下面是某化学兴趣小组的同学对氢氧化钠部分性质的探究过程:
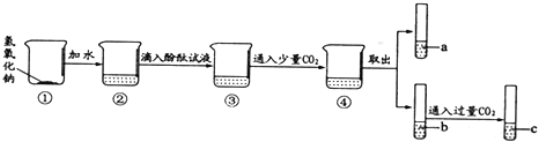
(1)用手触摸②的烧杯外壁,感觉发烫,这是由于氢氧化钠固体溶于水时会 (填“吸热”或“放热”),该溶液呈 色;③中的溶液显 色.
(2)从③到④溶液的颜色变化不明显,说明④中的溶液呈 性(填“酸”或“碱”).
(3)c溶液和a溶液对比,c溶液颜色更浅.
【提出问题】
为什么继续通入过量的二氧化碳气体溶液颜色会更浅?
【设计实验】
实验操作 | 实验现象 | 实验结论 | |
甲 | 取少量c溶液滴入稀盐酸 | 有气泡产生 | 溶液中含较多的CO32﹣或HCO3﹣ |
乙 | 另取少量c溶液滴入硝酸钙溶液 | 无明显现象 | 溶液中没有大量的 离子 |
【实验结论】
根据甲、乙两个实验得出的结论,写出甲实验中发生反应的化学方程式: .
【实验反思】
同种反应物在不同的条件下发生化学反应时,可能得到不同的产物.如:碳在氧气中燃烧可以生成 或 .
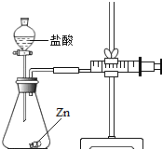
【题目】化学兴趣小组的同学对“影响金属与盐酸反应的剧烈程度的因素”进行了探究
【提出问题】金属与盐酸反应剧烈程度受哪些因素的影响?
【作出猜想】a、可能与金属本身的性质有关
b、可能与盐酸的浓度有关
【设计探究】实验所用金属均已用砂纸打磨.
实验(1)为探究猜想a,小组同学分别在两支试管中放入相同质量的锌片和铁片,然后分别加入相同尝试和质量的稀盐酸,观察到放锌片的试管中立即产生大量气泡,放铁片的试管中只产生少量气泡,发生反应的化学方程式有 .
从实验现象可判断:金属活动性Zn Fe(填“<”“=”“>”).
得出结论:金属与盐酸发生反应的剧烈程度与金属本身性质有关,金属的活动性与反应的剧烈程度的关系是 .
实验(2)为探究猜想b,小组同学设计如图的装置进行实验,其中注射器的作用是 .所用药品,实验数据如下表:
实验编号 | 选用金属(均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
1分钟 | 1﹣2分钟 | 2﹣3分钟 | 3﹣4分钟 | 4﹣5分钟 | 前5分钟共收集气体 | |||
Ⅰ | 锌片 | 15% | 2.9 | 16.9 | 11.0 | 9.2 | 7.6 | 48.5 |
Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
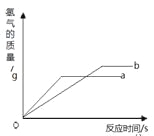
得出结论:金属与盐酸发生反应的剧烈程度与盐酸的浓度有关,其关系是
.
【反思评价】根据表一中实验Ⅱ数据分析,请描述锌与盐酸发生反应快慢的变化情况并解释原因
通过以上探究,你认为金属与盐酸反应的剧烈程度可能还受哪些因素的影响 (写一条即可).
【拓展延伸】很多金属不仅能与酸反应,也能与盐酸溶液反应,现将a g铁钉投入到CuSO4溶液中,反应一段时间后,将固体取出洗净、烘干,称重为b g,则生成铜的质量为 .