题目内容
【题目】某碳酸钠样品中混有少量氯化钠,根据如图所示信息完成相关计算。
(反应的化学方程式为:CaCl2+Na2CO3=CaCO3↓+2NaCl)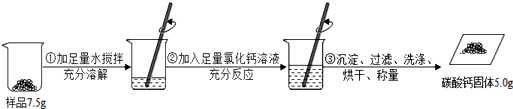
(1)Na2CO3由种元素组成;
(2)一个Na2CO3中Na、C、O的原子个数比为;
(3)Na2CO3中氧元素的质量分数是%(结果精确到0.1%);
(4)计算该样品中碳酸钠的质量分数。(写出计算过程,结果精确到0.1%)
【答案】
(1)三
(2)2:1:3
(3)45.3
(4)解:设样品中Na2CO3的质量为x
CaCl2+ | Na2CO3= | CaCO3↓+2NaCl |
106 | 100 | |
x | 5g |
![]()
x=5.3g
该样品中碳酸钠的质量分数为 ![]() ≈70.7%
≈70.7%
答:样品中Na2CO3的质量分数为70.7%。
【解析】解:(1)Na2CO3由钠元素、碳元素和氧元素三种元素组成的;(2)根据化学式可知,一个Na2CO3中Na、C、O的原子个数比为 2:1:3;(3)Na2CO3中氧元素的质量分数 ![]() ≈45.3%;
≈45.3%;
所以答案是:(1)三;(2) 2:1:3;(3)45.3%;(4)70.7%。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目