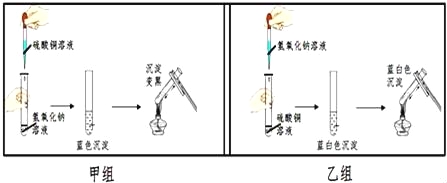
题目内容
【题目】甲班学生做完实验室制备氧气和还原金属氧化物的实验后,剩余物质倒入同一废液缸里。乙班课外兴趣小组同学进行了如图所示的探究。请回答:
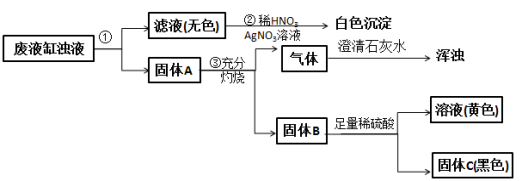
(1)步骤①的操作名称是___________,所用到的玻璃仪器有漏斗、玻璃棒和___________。
(2)由步骤②实验现象推知,甲班同学制取氧气所用的固体反应物是___________(写化学式)。
(3)由步骤④所得溶液加入氢氧化钠可得红棕色沉淀,该反应的化学方程式为______________________。
(4)由步骤③产生的气体判断固体A中一定含有___________(写名称);综合步骤③④现象推理,固体A中还可能含有的物质是______________________(写至少两种物质的化学式)。
(5)根据上述实验和分析判断固体是___________(写化学式)。
【答案】(1)过滤 烧杯
(2)KClO3
(3)Fe2(SO4)3+6NaOH=2Fe(OH)3![]() +3Na2SO4
+3Na2SO4
(4)炭 ;MnO2 、Fe、Fe2O3(任写两个)
(5)MnO2
【解析】
试题分析:(1)通过步骤1分别得到了固体和溶液,故是过滤操作;过滤时需要漏斗、玻璃棒和烧杯;
(2)无色溶液中加入硝酸银得到了白色沉淀,该白色沉淀是氯化银沉淀,即溶液中含有氯离子,故是用加热氯酸钾的方法制取氧气;氯酸钾分解生成氯化钾,氯化钾与硝酸银反应生成氯化银沉淀;
(3)由步骤④所得溶液加入氢氧化钠可得红棕色沉淀,红棕色沉淀是氢氧化铁沉淀,即所得溶液中含有铁离子;故金属氧化物是氧化铁;氧化铁与稀硫酸反应生成硫酸铁和水,硫酸铁和氢氧化钠反应生成氢氧化铁沉淀和硫酸钠:Fe2(SO4)3+6NaOH=2Fe(OH)3![]() +3Na2SO4;
+3Na2SO4;
(4)还原金属氧化物的实验中需要还原剂,步骤3中灼烧生成了二氧化碳,故固体A中含有碳;用氯酸钾制取氧气需要二氧化锰做催化剂,故含有二氧化锰;碳还原氧化铁会生成铁。故固体A中含有碳、铁、二氧化锰和氧化铁;
(5)固体C是黑色的,碳会与氧气反应掉,铁会与稀硫酸反应,故是二氧化锰。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案