题目内容
【题目】密闭体系中进行“氢气和氧气”的燃烧反应,对此理解正确的是( )
A. 参加反应的氢气质量可以无限减小
B. 通入2g氢气,一定能生成18g水
C. 参加反应的氢气与氧气的质量比一定符合1∶16
D. 氢气、氧气以任意质量比反应,变化前后总质量都不变
【答案】D
【解析】
A、氢气与氧气反应的化学方程式为2H2+O2![]() 2H2O,参加反应的氢气质量不能无限减小,故A错误;
2H2O,参加反应的氢气质量不能无限减小,故A错误;
B、通入2g 氢气,若氧气的量不足,不能生成 18g 水,故B错误;
C、根据氢气与氧气反应的化学方程式2H2+O2![]() 2H2O可知,参加反应的氢气与氧气的质量比一定符合4:32=1:8,故C错误;
2H2O可知,参加反应的氢气与氧气的质量比一定符合4:32=1:8,故C错误;
D、由于是在密闭体系中进行“氢气和氧气”的燃烧反应,氢气、氧气以任意质量比反应,变化前后总质量都不变,故D正确。故选D。

【题目】研究性学习小组选择“H2O2生成O2的快慢与什么因素有关”的课题进行探究,以下是他们探究的主要过程:
(假设)H2O2生成O2的快慢与催化剂种类有关
(实验方案)常温下,各取同质量、同浓度的H2O2溶液,分别加入相同质量的MnO2和水泥块,测量各生成一瓶(相同体积)O2所需的时间。
(进行实验)如图是他们进行实验的装置图,此实验中B处收集氧气的方法是_________法或_________法。
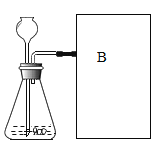
(实验记录)
实验编号 | 1 | 2 |
反应物 | 5% H2O2 | 5% H2O2 |
催化剂 | 1g水泥块 | 1g MnO2 |
时间 | 165秒 | 46秒 |
(结论)比较数据你得出的结论是____________________________________。
(反思)H2O2在常温下分解缓慢,加入MnO2或水泥块后反应明显加快,若要证明MnO2和水泥块是该反应的催化剂,还需要增加实验来验证MnO2和水泥块在化学反应前后的_________和_________
是否发生改变。通过测定二氧化锰是过氧化氢反应的催化剂,请写出过氧化氢在二氧化锰作催化剂反应的化学方程式_____________________________。
分解H2O2生成O2的快慢与哪些因素有关?请你帮助他们继续探究。(只要求提出一种影响H2O2生成O2的快慢的因素以及相关假设和实验方案)
(假设)_____________________________________________。
(实验方案)_________________________________________。