题目内容
(1)合理使用化肥是保证农作物正常生长的重要条件,氮肥硝酸铵(NH4NO3)中氮元素与氢元素质量比为
(2)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应.反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯质量,且气体溶解忽略不计).则所取石灰石中碳酸钙质量是多少?稀盐酸中溶液质量分数是多少?
(2)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应.反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯质量,且气体溶解忽略不计).则所取石灰石中碳酸钙质量是多少?稀盐酸中溶液质量分数是多少?
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算,元素质量比的计算
专题:溶质质量分数与化学方程式相结合的计算
分析:(1)根据化合物中各元素质量比=各原子的相对原子质量×原子个数之比,进行分析解答.
(2)根据碳酸钙的化学性质可知,加入稀盐酸时,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;根据质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出参加反应的碳酸钙的质量,进而计算出稀盐酸中溶液质量分数.
(2)根据碳酸钙的化学性质可知,加入稀盐酸时,碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳;根据质量守恒定律,烧杯内质量的减少的质量即生成的二氧化碳质量,据此根据反应的化学方程式列式计算出参加反应的碳酸钙的质量,进而计算出稀盐酸中溶液质量分数.
解答:解:(1)硝酸铵(NH4NO3)中氮元素与氢元素质量比为(14×2):(1×4)=7:1.
(2)生成二氧化碳气体的质量为12g+100g-107.6g=4.4g.
设所取石灰石中碳酸钙质量是x,稀盐酸中溶液质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
=
x=10g
=
y=7.3g
稀盐酸中溶液质量分数是
×100%=7.3%.
答:(1)7:1;(2)所取石灰石中碳酸钙质量是10g;稀盐酸中溶液质量分数是7.3%.
(2)生成二氧化碳气体的质量为12g+100g-107.6g=4.4g.
设所取石灰石中碳酸钙质量是x,稀盐酸中溶液质量为y,
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
x y 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
| 73 |
| 44 |
| y |
| 4.4g |
稀盐酸中溶液质量分数是
| 7.3g |
| 100g |
答:(1)7:1;(2)所取石灰石中碳酸钙质量是10g;稀盐酸中溶液质量分数是7.3%.
点评:本题难度不大,掌握根据化学式与化学方程式的计算即可正确解答本题,根据质量守恒定律计算出二氧化碳气体的质量是正确解答本题的关键.

练习册系列答案
相关题目
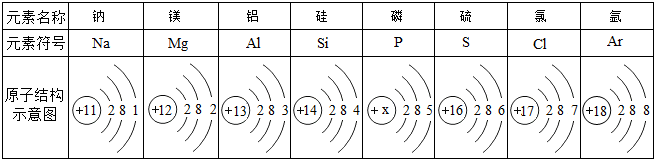
与元素的化学性质关系密切的是元素原子的( )
| A、最外层电子数 | B、核外电子层数 |
| C、核内中子数 | D、质量 |

 学习化学,不能只满足于对书本知识的掌握,要注重联系生活实际,要树立从化学视角分析问题的意识.
学习化学,不能只满足于对书本知识的掌握,要注重联系生活实际,要树立从化学视角分析问题的意识.