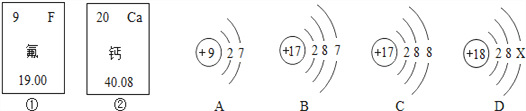
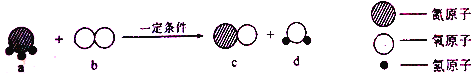题目内容
【题目】如下是探究铁生锈条件的实验装置图:

【实验步骤】
(1)按图1所示装配仪器并装好试剂(装置气密性良好),观察试管①和②中铁钉的生锈情况。
(2)打开分液漏斗活塞,直至试管①中一半的冷却沸水排入试管②时(如图2所示),停止实验。观察试管③和④中铁钉的生锈情况。
【实验现象】
试管①和②中的铁钉不生锈,试管③和④中的铁钉生锈,且试管③比试管④中的铁钉生锈严重。
【实验说明】
本实验使用的仪器均已干燥,且锥行瓶体积较小,忽略锥行瓶内原有空气对实验的影响。
【实验分析】
(1)锥形瓶内发生反应的化学方程式为______________________________________________。
(2)要实现“试管①中一半的冷却沸水排入试管②”,带a、b导管的橡皮塞可选择(_________)。

(3)下图是实验后试管③中的铁钉,其中生锈最严重的是__________(选填a、b或c)处。铁锈的主要成分是___________(填名称)
![]()
(4)试管③中的铁钉比试管④中的铁钉生锈严重的原因是____________________。
(5)下列有关对实验结论的分析,正确的是(_________)
A. 对比试管①③中的铁钉生锈情况,可知铁生锈需要氧气;
B.对比试管①④中的铁钉生锈情况,可知铁生锈需要水
C.对比②③中的铁钉生锈情况,可知铁生锈需要氧气
D.对比②④中的铁钉生锈情况,可知铁生锈需要水
(6)该实验中,若用“冷却的食盐水(不含氧气)”代替“冷却的沸水”,则试管③中的铁钉生锈速度____________(选填“更慢”、“更快”或“不受影响”)。
(7)该实验中,若用“锌粒”代替“二氧化锰”,用“稀硫酸”代替“双氧水”,则对比各试管中的铁钉生锈情况,________(选填“能”、“不能”)得出铁生锈需要的条件。
【答案】 2H2O2![]() 2H2O+O2↑ B b 三氧化二铁 试管③中氧气的浓度大 AC 更快 不能
2H2O+O2↑ B b 三氧化二铁 试管③中氧气的浓度大 AC 更快 不能
【解析】(1)过氧化氢在二氧化锰催化下生成水和氧气,反应的化学方程式为:2H2O2MnO2 2H2O+O2↑;(2)分析四套装置的的特点:要实现“试管①中一半的冷却沸水排入试管②”,带a、b导管的橡皮塞可选择B;(3)铁在潮湿的空气中易生锈,所以b处最严重;铁锈的主要为三氧化二铁;(4)试管③中的铁钉比试管④中的铁钉生锈严重的原因是:试管③中氧气的浓度大;(5)A、对比试管①③中的铁钉生锈情况,可知铁生锈需要氧气,故正确;B、对比试管①④中的铁钉生锈情况,可知铁生锈需要水,故错误;C、对比②③中的铁钉生锈情况,可知铁生锈需要氧气,故正确;D、对比②④中的铁钉生锈情况,可知铁生锈需要水,故错误;故选AC;(6)在食盐水中铁钉生锈速度更快;(7)锌和稀硫酸反应的化学方程式为:Zn+ H2SO4 = ZnSO4+H2↑,铁生锈与氢气无关,所以不能得出铁生锈需要的条件。

【题目】实验中学9班化学兴趣小组就空气中氧气的含量进行实验探究:
【集体讨论】:
(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其它成分反应,而且生成物为固体。他们应该选择(填编号)___,
A. 蜡烛 B.红磷 C.木炭
为了充分消耗容器中的氧气,药品的用量应保证__________.
(2)小组同学共同设计了如下图的两套装置,你认为合理的是_____________(填编号).为了确保实验成功,在装药品前应该__________.
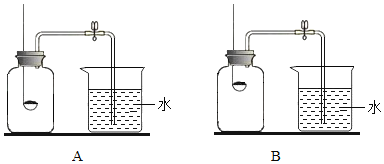
【分组实验】:在讨论的基础上,他们分组进行了实验.
【数据分析】:实验结束后,整理数据如下:(注:集气瓶容积为100mL)
组别 | 1 | 2 | 3 | 4 | 5 | 6 |
进入集气瓶中水的体积(mL) | 20 | 21 | 19 | 20 | 22 | 18 |
(3)通过对实验结果的交流,大多数同学都验证出氧气约占空气体积的_____________.通过实验还可以推断集气瓶中剩余气体的物理性质是__________、化学性质是___________.
【实验拓展】:
(4)已知镁在空气中燃烧可分别与氧气和氮气反应,都生成固体物质,此实验中镁___(填“能”或“不能”)代替红磷,其原因是___.