题目内容
【题目】(1)历史上,道尔顿认为,原子是一个个简单的、不可分割的实心球体。现在你认为该观点___(选填“正确”或“错误”)。
(2)元素周期律是学习和研究化学的重要工具。下表是元素周期表的部分信息:
1H 氢 | 2He 氦 | |||||||
3Li 锂 | 4Be 铍 | 5B 硼 | 6C 碳 | 7N 氮 | 8O 氧 | 9F 氟 | 10Ne 氖 | |
llNa 钠 | 12Mg 镁 | 13A1 铝 | 14Si 硅 | 15P 磷 | 16S 硫 | 17C1 氯 | 18Ar 氩 | |
19K 钾 | 20Ca 钙 | …… | ||||||
认真分析信息,回答:
 表示的是(填名称)__________;
表示的是(填名称)__________;
(3)上表中每一周期元素原子序数的变化规律是____________________________。
(4)上表中硫元素的每个原子需要得到___个电子形成相对稳定结构的离子,该离子与Na+形成化合物的化学式为___。
(5)亚氯酸钠(NaClO2)是一种重要的消毒剂,其中氯元素的化合价为___。
【答案】 错误 Cl- 从左到右原子序数依次增大 2 Na2S +3
【解析】(1)历史上,道尔顿认为,原子是一个个简单的、不可分割的实心球体。现在认为该观点是错误的。(2)元素周期律是学习和研究化学的重要工具。 表示的是Cl-,核内17个质子,核外18个电子。 (3)每一周期元素原子序数的变化规律是从左到右原子序数依次增大。(4) 硫元素的每个原子需要得到2个电子形成相对稳定结构的离子,根据正负总价代数和为零原则,该离子与Na+形成化合物的化学式为Na2S。(5)亚氯酸钠(NaClO2)是一种重要的消毒剂,其中氯元素的化合价为∶﹙+1﹚+x+﹙-2﹚×2=0,x=+3 .
表示的是Cl-,核内17个质子,核外18个电子。 (3)每一周期元素原子序数的变化规律是从左到右原子序数依次增大。(4) 硫元素的每个原子需要得到2个电子形成相对稳定结构的离子,根据正负总价代数和为零原则,该离子与Na+形成化合物的化学式为Na2S。(5)亚氯酸钠(NaClO2)是一种重要的消毒剂,其中氯元素的化合价为∶﹙+1﹚+x+﹙-2﹚×2=0,x=+3 .
点睛∶原子并不是一个个简单的、不可分割的实心球体,具有复杂的内部结构。原子可以通过得失电子变为离子,化学式的书写应符合正负总价代数和为零原则。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案【题目】空气中氧气含量测定的再认识.
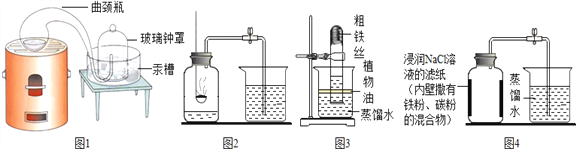
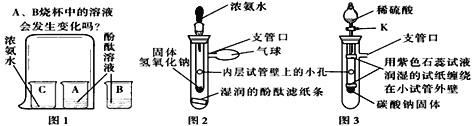
【经典赏析】教材中介绍了拉瓦锡用定量的方法研究了空气的成分(实验装置如图1).该实验中选择使用汞的优点有 ____________.
A.实验过程中没有污染
B.在汞槽中起到液封作用
C.生成的化合物加热分解又能得到汞和氧气
D.能将密闭装置内空气中的氧气集合耗尽
【实验回顾】实验室常用红磷燃烧的方法测定空气中氧气的含量(装置如图2),写出红磷燃烧的文字表达式________.兴趣小组用该方法测出的氧气含量常常远低于21%.
【提出问题】用红磷燃烧的方法为什么不能准确地测定空气中氧气的含量?
【进行猜想】(1)装置漏气;(2)_________装置内氧气有剩余;…
【实验探究1】小明根据铁生锈的原理,探究用铁能否准确测定空气中氧气的含量,于是进行了实验(装置如图3)通过7天测得的数据计算空气中氧气的含量为19.13%.
【交流与反思】与用红磷燃烧的方法相比,用铁丝生锈的方法测定结果更准确的原因:___________________.
【实验探究2】为了加快反应速率,小明通过查阅资料,利用铁粉、炭粉、氯化钠等物质又进行了实验(装置如图4),8分钟后测得的数据如表:
实验前的体积 | 实验后的体积 | |
集气瓶内空气 | 烧杯内蒸馏水 | 烧杯内剩余蒸馏水 |
131mL | 90.0mL | 63.6mL |
请计算出空气中氧气含量________(计算结果保留一位小数)
【结论与反思】通过上述实验探究,选择________(填物质名称)进行实验,可较为快速地完成实验并减小实验误差.
【拓展延伸】铜也能与空气中氧气、水、二氧化碳反应而锈蚀,生成铜绿[铜绿的主要成分为Cu2(OH)2CO3],若将图3装置中的粗铁丝换成足量的铜丝进行实验,请判断能否比较准确地测定空气中氧气的含量,并说明理由。 ________(填“能”或“不能”),理由____________。(提示:铜与空气中氧气、水、二氧化碳反应锈蚀时,当参加反应的氧气和二氧化碳的体积相等时,反应才能恰好完成。)