题目内容
【题目】实验课上,老师给了同学们一包红色粉末,该粉末可能是铜粉和氧化铁(Fe2O3)粉末中的一种或两种,为确定该粉末的成分,同学们进行了如下探究,请你参与其中并回答问题。
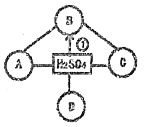
[提出猜想]甲组:铜粉;乙组:氧化铁粉末;丙组:____________________。
[设计实验]
方案1:取少量红色粉末放入试管中,滴加足量的___________(从下列试剂中选择:氯化钠溶液、稀盐酸、氢氧化钠溶液)振荡,若甲组猜想正确,则实验现象为__________________。
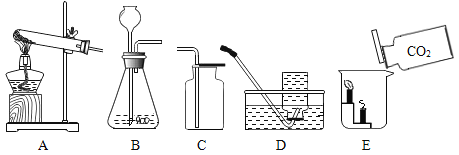
方案2:取8g红色粉末放入硬质玻璃管中,先通入CO,然后用酒精喷灯加热一段时间(实验装置如图1所示),停止加热并继续通入CO至装置冷却。
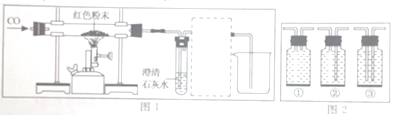
若乙组或丙组猜想正确,则硬质玻璃管内发生反应的化学方程式是____________。
实验时要先通CO再加热的目的是______________________。
[数据处理]
等装置完全冷却到室温,称量硬质玻璃管内剩余固体质量为mg。若乙组猜想正确,则m的取值范围是________________。
[实验反思]
图1虚线框内的装置是用于吸收CO2;并收集CO,请从图2(广口瓶内均为氢氧化钠溶液)中选择最合适的装置______________(填序号)。
【答案】 铜粉和氧化铁粉末 稀盐酸 无明显现象 3CO+Fe2O3![]() 2Fe+3CO2 排尽硬质玻璃内空气,防止爆炸 5.6≤m<8 ③
2Fe+3CO2 排尽硬质玻璃内空气,防止爆炸 5.6≤m<8 ③
【解析】(1)丙的猜想可能是氧化铁和铜粉;
(2)铜不与酸反应,故可加入稀盐酸,如固体不溶解,则说明只有铜,猜想甲正确;
(3)硬质玻璃管内是一氧化碳与氧化铁在高温的条件下反应生成铁和二氧化碳,反应方程式为3CO+Fe2O3![]() 2Fe+3CO2 ;实验时要先通CO再加热的目的是排尽硬质玻璃内空气,防止爆炸;管中剩余固体可能是单质铁或铁与氧化铁的混合物,当完全是铁的时候,8个的氧化铁可以生成铁的质量为5.6个,当完全没有反应时,固体的质量为8g,故m的范围为5.6≤m <8 ;
2Fe+3CO2 ;实验时要先通CO再加热的目的是排尽硬质玻璃内空气,防止爆炸;管中剩余固体可能是单质铁或铁与氧化铁的混合物,当完全是铁的时候,8个的氧化铁可以生成铁的质量为5.6个,当完全没有反应时,固体的质量为8g,故m的范围为5.6≤m <8 ;
(4)吸收二氧化碳需要导管通入氢氧化钠溶液中,收集一氧化碳需要用排水法收集,故导管也要插入集气瓶底,故选③;

 春雨教育同步作文系列答案
春雨教育同步作文系列答案