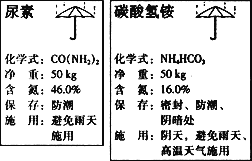
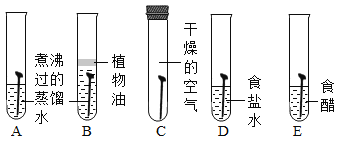
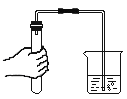
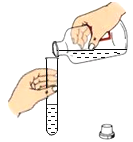
题目内容
【题目】“绿水青山就是金山银山”,水是生命之源。河水中含有泥沙、细菌等等杂质,需要净化成自来水,自来水厂净化水的过程过程如图所示。
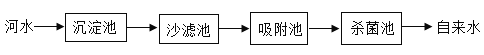
(1)为了使沉淀池的悬浮物沉降,通常可加入_____。
(2)吸附池中加入______可除去水中的异味或有色物质。
(3)洗衣服时产生的泡沫少,且有白色垢状物,则该水是_____(填“硬水”或“软水”)。
(4)对于静置沉淀、吸附沉淀、过滤、蒸馏等净化水的操作,单一操作相对于净化程度较高的是______。
(5)实验室用电解水的实验探究水的组成元素,其反应方程式为_____。
(6)自来水中含有少量的Ca(HCO3)2等可溶性化合物,烧水时Ca(HCO3)2反应生成难溶性的碳酸钙、水和二氧化碳,这就是水垢的原因之一。请写出其受热分解的化学方程式______。
【答案】明矾 活性炭 硬水 蒸馏 2H2O![]() 2H2↑+ O2↑ Ca(HCO3)2
2H2↑+ O2↑ Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O
CaCO3↓+CO2↑+H2O
【解析】
(1)明矾溶于水后形成的胶状物会吸附水中的悬浮杂质而加速沉降,所以为了使沉淀池的悬浮物沉降,通常可加入明矾;故填:明矾;
(2)活性炭常用于吸附池中,原因是它具有疏松多孔的结构,可除去水中的异味或有色物质;故填:活性炭;
(3)硬水中加入肥皂水后会产生大量的白色垢状物,泡沫少;而软水中会产生大量的泡沫,故填:硬水;
(4)蒸馏可以除去水中的所有杂质,所以对于静置沉淀、吸附沉淀、过滤、蒸馏等净化水的操作中,单一操作相对净化程度较高的是蒸馏;故填:蒸馏;
(5)水在通电的条件下分解为氢气和氧气;故填:2H2O![]() 2H2↑+O2↑;
2H2↑+O2↑;
(6)Ca(HCO3)2受热分解生成碳酸钙、水和二氧化碳,其化学方程式为:Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O;故填:Ca(HCO3)2
CaCO3↓+CO2↑+H2O;故填:Ca(HCO3)2![]() CaCO3↓+CO2↑+H2O。
CaCO3↓+CO2↑+H2O。