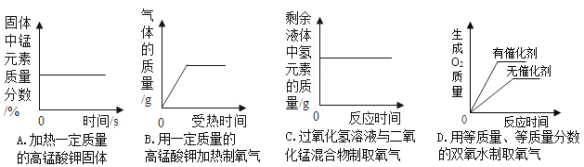
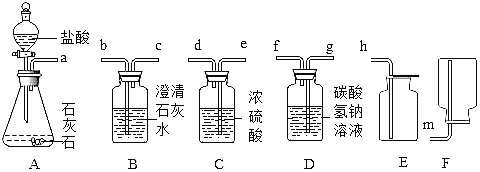
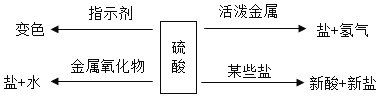
题目内容
【题目】氧化钴(CoO)溶于盐酸可得到粉红色的氯化钴(CoCl2)溶液。CoCl2含结晶水数目不同而呈现不同颜色。利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。如图是粉红色的六水氯化钴晶体(CoCl26H2O)受热分解时,剩余固体质量随温度变化的曲线。
已知:①CoCl26H2O的相对分子质量为CoCl2和6个结晶水的相对分子质量之和。
②CoCl26H2O受热分解完全脱水的化学方程式为:
CoCl26H2O![]() CoCl2+6H2O。
CoCl2+6H2O。
请回答:
(1)CoCl2的钴元素的化合价为_____价。
(2)求物质A(CoCl2xH2O)中的x值。
【答案】+2;2
【解析】
根据氯化钴的化学式结合化合物中化合价的代数和为零进行计算;物质A的化学式求算要结合给出的图中数据83gA完全失水后得到的固体为65g,据此计算。
解:(1)CoCl2的中氯元素为-1价,设钴元素的化合价为a,根据化合物中化合价的代数和为零,可得a+(-1)×2=0,得a=+2价;
(2)83g物质A(CoCl2xH2O)失水后得到的固体氯化钴为65g,则水的质量为18g,
CoCl2xH2O![]() CoCl2+xH2O
CoCl2+xH2O
13018x
65g18g
![]()
x=2,
答:(1)CoCl2的钴元素的化合价为+2价,(2)物质A(CoCl2xH2O)中的x值为2。

【题目】某研究小组发现,维C泡腾片(保健药品,主要成分见图1)溶于水,有许多气泡产生(如图2)。该小组同学进行如下探究。
探究一:该气体的成分。
【猜想与假设】小华说:该气体可能是CO2、O2、CO、H2、N2。
小明说:不可能含有N2,因为_________________________。
小芳说:不可能含有CO和H2,因为从药品安全角度考虑,H2易燃易爆,CO_____________________________。
该小组同学认为:该气体可能含有CO2、O2中的一种或两种。
【进行实验】
实验编号 | 实验操作 | 实验现象 |
① | 将气体通入澄清的石灰水中 | 澄清石灰水变浑浊 |
② | 将带火星的木条伸入该气体中 | 带火星的木条没有复燃 |
【得出结论】(1)由实验①可知,该气体中肯定含有_________,写出该反应的化学方程式________________。
(2)由实验②____________(填“能”或“不能”)确定该气体中不含氧气,理由是______________________。
探究二:维C泡腾片溶液的酸碱性。
向维C泡腾片溶液中滴加石蕊试液,溶液变红,说明溶液显_________性。