题目内容
【题目】某合作学习小组的同学们.欲测定一定量的某种石灰石样品中碳酸钙的质量,进行了如下实验:
(1)配制溶质质量分数为7.3%的稀盐酸.
①配制100g溶质质量分数为7.3%的稀盐酸,需图1所示盐酸的质量 g.
②量取盐酸与水时,视线要与量筒内液体凹液面的保持水平.再读出液体的体积;将两种液体都倒人中(填仪器名称),用玻璃棒搅拌,使溶液混合均匀.
(2)将(1)中配制好的稀盐酸加人盛有石灰石样品的烧杯中,产生气体的质量与加入稀盐酸的质量关系如图2所示(假设石灰石样品中的杂质不与稀盐酸反应).
计算:该石灰石样品中碳酸钙的质量.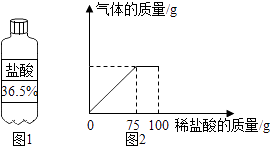
【答案】
(1)20;最低处;烧杯
(2)
解:设 参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 73
x 75g×7.3%
![]() =
= ![]()
x=7.5g;
答:该石灰石中碳酸钙的质量为7.5g
【解析】解:(1)①用这瓶浓盐酸来配制100g溶质质量分数为7.3%的稀盐酸,需量取这种浓盐酸的质量是 ![]() =20g;②量取盐酸与水时,视线要与量筒内液体凹液面的最低处保持水平,再读出液体的体积;将两种液体都倒人烧杯中,用玻璃棒搅拌,使溶液混合均匀.
=20g;②量取盐酸与水时,视线要与量筒内液体凹液面的最低处保持水平,再读出液体的体积;将两种液体都倒人烧杯中,用玻璃棒搅拌,使溶液混合均匀.
(1)依据稀释前后溶质的质量不变分析作答,根据量筒的使用方法及溶液的配制方法分析作答;(2)根据化学方程式的基本计算对相关的计算进行分析即可;

练习册系列答案
相关题目