题目内容
请根据下列装置图回答问题:
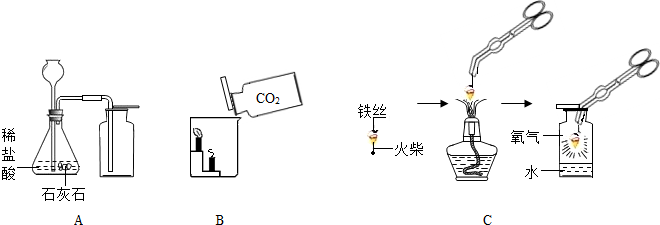
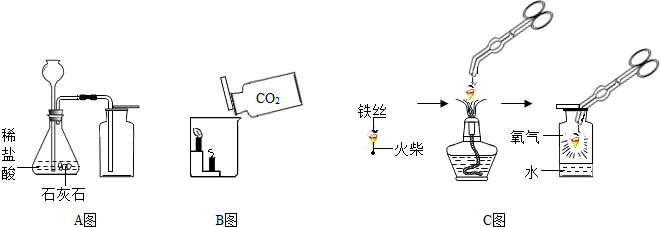
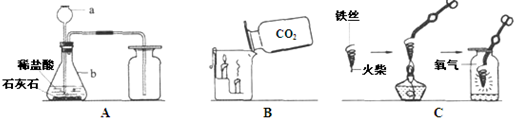
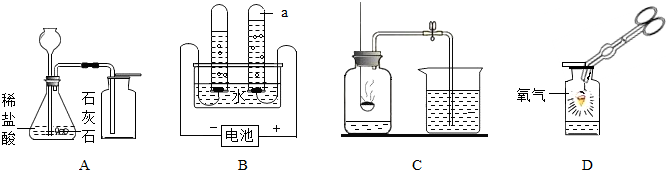
(1)A中制取气体的化学方程式为______;A装置还可用于实验室制取另一种气体,化学方程式为______.
(2)B中,将二氧化碳气体慢慢倒入放有燃着蜡烛的烧杯中,观察到的现象是:______,说明二氧化碳具有______性质,这一性质在实际生活中的应用为______.
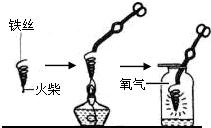
(3)小明在做铁丝在氧气中燃烧的实验时,为了防止集气瓶壁炸裂,正确的操作是______.
(4)小明对铁丝在氧气中燃烧为什么会火星四射进行探究.他将镁和不同含碳量的铁丝(镁和铁直径均为0.4mm)放入氧气中燃烧,并将现象记录在下表中.
| 物质 | 镁 | 含碳0.05%的铁 | 含碳0.2%的铁 | 含碳0.6%的铁 |
| 燃烧时的现象 | 剧烈燃烧,发出耀白光,无火星 | 剧烈燃烧极少火星 | 剧烈燃烧少量火星 | 未填 |
②造成铁丝在氧气中燃烧时火星四射的主要原因是______.
解:(1)石灰石和稀盐酸反应生成氯化钙、水和二氧化碳,方程式是CaCO3+2HCl=CaCl2+CO2↑+H2O;A装置的发生装置适用于固体和液体不需加热制取气体,向上排空气法收集密度比空气大的气体,实验室用双氧水制取氧气可用此装置,反应的化学方程式是 2H2O2 2H2O+O2↑;
2H2O+O2↑;
(2)由于二氧化碳的密度比空气大,不能燃烧,也不能支持燃烧,所以将二氧化碳气体慢慢倒入放有燃着蜡烛的烧杯中,可观察到下层的蜡烛先熄灭,上层的蜡烛后熄灭,根据二氧化碳的这一性质特点,生活中常用其灭火;
(3)在做铁丝在氧气中燃烧的实验时,为了防止集气瓶壁炸裂,应将燃着的细铁丝伸入集气瓶中央,不要碰到集气瓶壁,因为铁丝燃烧生成的四氧化三铁温度很高,碰触到集气瓶壁会使集气瓶壁炸裂;
(4)根据记录表现象:含碳0.05%的铁,在氧气中剧烈燃烧极少火星,含碳0.2%的铁,剧烈燃烧少量火星,由此可知:造成铁丝在氧气中燃烧时火星四射的主要原因是:铁丝中含有一定量的碳引起的,随着含碳量的增加,火星越剧烈,故含碳0.6%的铁,在氧气中剧烈燃烧,火星四射;
故答案为:(1)CaCO3+2HCl=CaCl2+CO2↑+H2O; 2H2O2 2H2O+O2↑;
2H2O+O2↑;
(2)下层的蜡烛先熄灭,上层的蜡烛后熄灭; 不可燃、不支持燃烧、密度比空气大; 灭火;
(3)将燃着的细铁丝伸入集气瓶中央;
(4)①剧烈燃烧,火星四射; ②铁丝中含有一定量的碳引起的.
分析:(1)石灰石和稀盐酸反应生成氯化钙、水和二氧化碳,据此书写方程式;A装置的发生装置适用于固体和液体不需加热制取气体,向上排空气法收集密度比空气大的气体,实验室用双氧水制取氧气可用此装置;
(2)二氧化碳的密度比空气大,不能燃烧,也不能支持燃烧,据此分析解答相关问题;
(3)据铁丝燃烧的注意事项分析解答;
(4)铁丝在氧气中剧烈燃烧、火星四射,并结合实验现象记录分析解答.
点评:本题考查了对实验室制取二氧化碳、铁丝燃烧的相关知识,同时考查了学生分析、解决问题的能力.
 2H2O+O2↑;
2H2O+O2↑;(2)由于二氧化碳的密度比空气大,不能燃烧,也不能支持燃烧,所以将二氧化碳气体慢慢倒入放有燃着蜡烛的烧杯中,可观察到下层的蜡烛先熄灭,上层的蜡烛后熄灭,根据二氧化碳的这一性质特点,生活中常用其灭火;
(3)在做铁丝在氧气中燃烧的实验时,为了防止集气瓶壁炸裂,应将燃着的细铁丝伸入集气瓶中央,不要碰到集气瓶壁,因为铁丝燃烧生成的四氧化三铁温度很高,碰触到集气瓶壁会使集气瓶壁炸裂;
(4)根据记录表现象:含碳0.05%的铁,在氧气中剧烈燃烧极少火星,含碳0.2%的铁,剧烈燃烧少量火星,由此可知:造成铁丝在氧气中燃烧时火星四射的主要原因是:铁丝中含有一定量的碳引起的,随着含碳量的增加,火星越剧烈,故含碳0.6%的铁,在氧气中剧烈燃烧,火星四射;
故答案为:(1)CaCO3+2HCl=CaCl2+CO2↑+H2O; 2H2O2
 2H2O+O2↑;
2H2O+O2↑;(2)下层的蜡烛先熄灭,上层的蜡烛后熄灭; 不可燃、不支持燃烧、密度比空气大; 灭火;
(3)将燃着的细铁丝伸入集气瓶中央;
(4)①剧烈燃烧,火星四射; ②铁丝中含有一定量的碳引起的.
分析:(1)石灰石和稀盐酸反应生成氯化钙、水和二氧化碳,据此书写方程式;A装置的发生装置适用于固体和液体不需加热制取气体,向上排空气法收集密度比空气大的气体,实验室用双氧水制取氧气可用此装置;
(2)二氧化碳的密度比空气大,不能燃烧,也不能支持燃烧,据此分析解答相关问题;
(3)据铁丝燃烧的注意事项分析解答;
(4)铁丝在氧气中剧烈燃烧、火星四射,并结合实验现象记录分析解答.
点评:本题考查了对实验室制取二氧化碳、铁丝燃烧的相关知识,同时考查了学生分析、解决问题的能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
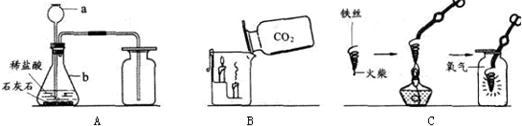
 22、请根据下列装置图回答问题:
22、请根据下列装置图回答问题: