题目内容
【题目】氯化铵和硝酸钾的溶解度曲线如右图所示,回答下列问题:

(1)40℃时将40g硝酸钾投入到50g水中,充分搅拌,得到的溶液的质量是 g。
(2)60℃时将60g硝酸钾完全溶解100g水中,冷却到a℃,析出晶体 g。
(3)将a℃硝酸钾和氯化铵饱和溶液分别升高温度至60℃,此时溶液中溶质的质量分数是硝酸钾溶液 (填“大于”、“等于”、“小于”)氯化铵溶液。
(4)硝酸钾中含有少量氯化铵,提纯硝酸钾的方法是 。
【答案】(1)82(2)20(3)等于(4)降温结晶(或冷却结晶、或冷却热饱和溶液结晶)
【解析】
试题分析:(1)40℃时硝酸钾的溶解度为64g,则50g水中只能溶解32g的硝酸钾,故得到的溶液的质量是82g;(2)冷却到a℃,硝酸钾的溶解度为40g则析出晶体为20g(3)a℃硝酸钾和氯化铵饱和溶液的溶解度相等,都升高温度,变为不饱和溶液,故相等。(4)硝酸钾的溶解度受温度影响大,故降温结晶析出硝酸钾晶体。

【题目】同学们查阅资料,镁是一种化学性质非常活泼的金属,可以在多种气体中燃烧。同学们用下图所示装置分别进行镁条在二氧化碳和氮气中燃烧的实验。B中观察到镁冒出淡黄色的烟,并闻到刺激性气味。同学们对两个反应进行了探究。
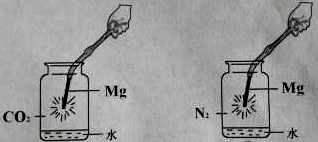
A B
[查阅资料]
①氧化镁、碳酸镁均可以和盐酸反应。
②氮化镁(Mg3N2),淡黄色固体,无味,遇水产生白色沉淀氢氧化镁,并产生有刺激
性气味的氨气(NH3)。
实验1探究A中生成黑色固体和白烟的成分。
[猜想与假设]1、黑色固体是炭。
2、白烟可能是MgO 、MgCO3或
[进行实验]
实验操作 | 实验现象 | 实验结论 |
①取A中生成的固体于试管中,加入适量稀盐酸 | 白色固体消失,无气泡生成。 | 。 |
②将①反应后的剩余物过滤,将滤渣洗涤干燥后在盛有氧气的集气瓶中点燃,熄灭后,向瓶中倒入澄清石灰水 | 黑色固体燃烧,发白光,放热,澄清石灰水变浑浊。 | 黑色固体是炭。 写出该实验中澄清石灰水发生反应的化学方程式 。 |
实验2 探究B中闻到刺激性气味的原因。
同学们根据查阅的资料分析,镁条在氮气中燃烧闻到刺激性气味的原因与集气瓶中的水有关。请你在已有实验的基础上,设计一个实验方案证明同学们的猜想正确。
。
[反思与评价]
通过探究,同学们对燃烧和灭火有了新的认识 。
【实际应用定量分析】