题目内容
【题目】现有HCl与CaCl2的混合溶液,为了分析混合溶液中HCl和CaCl2的质量分数,设计了如下实验方案:
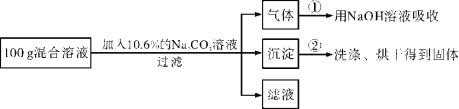
【实验数据】实验共记录了两组数据:第①组,气体吸收完全后,NaOH溶液质量增加4.4 g;第②组,沉淀完全后,经过滤、洗涤、烘干后得到固体的质量为10 g。
根据实验设计及有关数据进行分析与计算:
(1)混合溶液中HCl的质量分数为__________。(只写结果)
(2)混合溶液中CaCl2的质量分数为多少?(写出计算过程)
(3)实验中混合溶液与Na2CO3溶液恰好完全反应,经过滤后所得滤液中溶质的质量分数为__________。(不考虑过滤中的损失。只写结果,保留至小数点后一位)
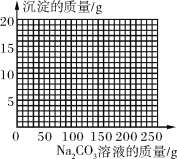
(4)若在100 g混合溶液中不断加入10.6% 的Na2CO3溶液,请你画出加入Na2CO3溶液的质量与产生沉淀的质量的关系图。
【答案】(1)7.3%;
(2)11.1%;
(3)8.2%;
(4)见图
【解析】
试题分析:(1)由题中的叙述可知盐酸与碳酸钠反应生成二氧化碳的质量为4.4g;根据方程式Na2CO3+2HCl==2NaCl+H2O+CO2↑,可知需要氯化氢为7.3g,则盐酸的溶质的质量分数为:7.3g/100g×100%=7.3%;生成氯化钠为11.7g;需要碳酸钠的质量为10.6g
(2)解:设混合溶液中CaCl2的质量为x。生成氯化钠的质量为y,需要碳酸钠的质量为z
CaCl2+Na2CO3===CaCO3↓+2NaCl
111 106 100 117
x z 10 g y
![]() 117/100=y/10g 106/100=z/10g
117/100=y/10g 106/100=z/10g
解得x=11.1 g y=11.7g z=10.6g
混合溶液中CaCl2的质量分数为11.1 g÷100 g×100%=11.1%
答:混合溶液中CaCl2的质量分数为11.1%。
(3)反应后溶液中的溶质为氯化钠,质量为11.7g+11.7g=23.4g;
溶液的质量为:100g+10.6/10.6%+10.6/10.6%-4.4g-10g=285.6g
故反应后溶液的溶质的质量分数为:23.4g/285.6g×100%=8.2%
(4)见下图曲线。