题目内容
【题目】已知A~G是初中化学常见的物质,A、B、C、E、F属于不同类别的物质,G溶液呈黄色,A与C反应产生白色沉淀(微溶物不列为沉淀),它们相互间发生反应或转化的关系如图所示(“—”表示两种物质间能发生反应,“→”表示两种物质间的转化关系,部分反应物、生成物和反应条件已经略去)。

(1)A的化学式为________;
(2)B与E反应的化学方程式为_________________,G→D的化学方程式为______________;
(3)A→D反应的实验现象为_________。
【答案】Ba(OH)2Fe+CuSO4===FeSO4+CuFeCl3+3NaOH===Fe(OH)3↓+3NaCl(合理即可)有红褐色沉淀生成_
【解析】
根据“G溶液呈黄色”,则推测含有铁离子;根据“A与C反应产生白色沉淀(微溶物)”,而A、B、C、E、F属于不同类别的物质,则结合图推测A为氢氧化钙,B为硫酸铜,C为稀硫酸,E为铁,F为氧化铁,而D为氢氧化铁,代入检验,符合题意.
(1)根据分析,A为氢氧化钙,F为氧化铁,故A、F的化学式分别为Ca(OH)2,Fe2O3。
(2)根据分析,B为硫酸铜,E为铁,故B与E反应的化学方程式为CuSO4+Fe=FeSO4+Cu;其反应的基本类型为置换反应;G→D的化学方程式为 FeCl3+3NaOH=Fe(OH)3↓+3NaCl或Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4.
(3)A→D反应的实验现象为生成红褐色沉淀.

【题目】研究小组在学习氧气的化学性质时发现:铁丝燃烧没有火焰,蜡烛燃烧却有明亮的火焰。该小组同学进行了如下探究。

(1)探究一:蜡烛燃烧产生火焰的原因是什么?
点燃蜡烛,将金属导管一端伸入内焰,导出其中物质,在另一端管口点燃,也有火焰产生(如图所示)。由此可知:蜡烛燃烧产生的火焰是由____________ (填“固态”或“气态”)物质燃烧形成的。
(2)探究二:物质燃烧产生火焰的根本原因是什么?
查阅资料:
物质 | 熔点/℃ | 沸点/℃ | 燃烧时温度/℃ |
石蜡 | 50~70 | 300~550 | 约600 |
铁 | 1 535 | 2 750 | 约1 800 |
钠 | 97.8 | 883 | 约1 400 |
由上表可知:物质燃烧能否产生火焰与其________(填“熔点”或“沸点”)和燃烧时温度有关。由此推测:钠在燃烧时,________(填“有”或“没有”)火焰产生。
(3)木炭在氧气中燃烧没有火焰,但生活中木炭燃烧时会产生火焰,其原因可能是_____________。
【题目】下表为第三周期元素的原子结构示意图。回答下列问题:
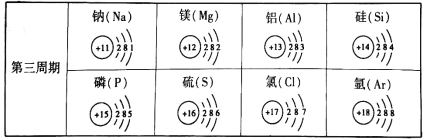
(1)在第三周期中,各原子结构的共同之处是_______________________。
(2)在第三周期中,元素类型的变化情况是:从左到右由________元素过渡到________元素,并以稀有元素气体结尾。
(3)在第三周期中,核外电子排布与氩原子相同的阴离子符号是______________。
(4)写出含有铝元素的常见氧化物、碱、盐。
物质的类别 | 氧化物 | 碱 | 盐 |
物质的化学式 | ________ | ________ | ________ |
【题目】如图是教材探究二氧化锰对过氧化氢的分解反应是否具有催化作用的实验装置图。请回答下列问题。
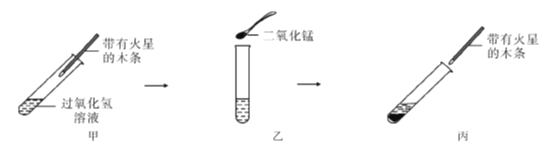
(1)丙图的实验现象是____________________,根据甲图实验的现象和丙图实验的现象的对比,可以说明二氧化锰对过氧化氢反应的影响是________________;此过程发生反应的化学方程式为_____________。
(2)如果在实验前用精密天平称量二氧化锰的质量,实验后把二氧化锰______________(填“操作”),再称量,发现二氧化锰的质量没有改变。
(3)仅凭上述实验还不能说明二氧化锰是过氧化氢分解反应的催化剂,因为上述实验还没有探究二氧化锰的化学性质是否改变,具体的做法是___________________________________________________。
(4)下表是张南同学探究影响H2O2分解因素时所记录的部分数据,通过对数据分析,你能得出的结论是______。
用足量等体积H2O2溶液制取相同体积O2所需的时间
催化剂/时间(min)/浓度 | 30%H2O2溶液 | 15%H2O2溶液 | 5%H2O2溶液 |
加入Wg MnO2 | 0.2 | 0.8 | 2.0 |