题目内容
【题目】某校化学活动小组用镁和铁探究金属的反应规律。
【查阅资料】
①镁,铁的活动性均在 H 之前并且镁比铁活泼。
②相同条件下,相同时间内金属的活动性越强,与酸反应越剧烈,产生的氢气越多。
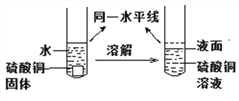
【探究一】在室温条件下进行如图所示实验。试管内的镁带和铁片表面均被打磨洁净,且形 状、大小相同;同时加入等质量和等浓度的稀盐酸。
(1)该兴趣小组的同学认为该方案中长颈漏斗起非常重要的作用。
①通过相同条件下,相同时间内长颈漏斗中 __________
②长颈漏斗在实验中还可以起_________________ 作用。
(2)在甲、乙装置的水中滴入 2~3 滴红墨水的目的_______________。
(3)乙装置中反应方程式为______________,该反应属于基本反应类型中的_______反应。
(4)观察到甲装置中产生气泡速率比乙装置快或 __________现象时,都可以证明镁的金属活动性比铁的强。

【探究二】方案二:如图丙,将等质量光亮洁净,形状厚薄相同的镁条和铁片分别放入左、 右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余,(U 型管内为水,初始液面相平,反应过程中装置气密性良好)。
(5)实验过程中 U 型管中液面 _______(填“左高右低”,“左低右高”,“相平”); 充分反应后,冷却到室温 U 型管中液面 ___________填“左高右低”,“左低右高”,“相平”),原因是_____。
【探究三】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出 的固体中滴加稀硫酸,没有气泡产生。下列判断正确的是 ________。写成发生反应的化学方程式 ________ 。
A.滤出的固体中一定含有铜 B.滤出的固体可能含有铁和镁
C.滤液中可能含有硫酸铜 D.滤液中一定含有硫酸镁和硫酸亚铁
【答案】 液面的高低 平衡内外压强 便于观察实验现象 Fe + 2HCl = H2↑ + FeCl2; 置换 甲中长颈漏斗的液面比乙中高 左低右高 ; 相平; 金属均有剩余,充分反应后生成的 H2 质量相等 A,B ; Mg + CuSO4 = Cu + MgSO4
【解析】镁和铁探究金属的反应规律。镁,铁的活动性均在 H 之前并且镁比铁活泼,镁和铁均可与盐酸或硫酸反应。相同条件下,相同时间内金属的活动性越强,与酸反应越剧烈,产生的氢气越多。【探究一】镁带和铁片表面均被打磨洁净,且形状、大小相同;同时加入等质量和等浓度的稀盐酸。(1)该方案中长颈漏斗起非常重要的作用。①通过相同条件下,相同时间内长颈漏斗中液面的高低。②长颈漏斗在实验中还可以起平衡内外压强作用,容器内压强过高,长颈漏斗液面上升。过低,液面下降,从而起到平衡内外压强作用。(2)在甲、乙装置的水中滴入 2~3 滴红墨水的目的是便于观察实验现象。(3)乙装置中反应方程式为. Fe+2HCl= H2↑+ FeCl2,该反应属于基本反应类型中的置换反应,一种单质和一种化合物反应,生成另一种单质和另一种化合物。(4)观察到甲装置中产生气泡速率比乙装置快或甲中长颈漏斗的液面比乙中高现象时,都可以证明镁的金属活动性比铁的强。【探究二】方案二:将等质量光亮洁净,形状厚薄相同的镁条和铁片分别放入左、 右试管中,加入等质量、等质量分数的稀盐酸,充分反应后,冷却到室温,金属均有剩余。(5)实验过程中 U 型管中液面左低右高,镁比锌活泼,反应较快,短时间内产生大量的氢气;充分反应后,冷却到室温 U 型管中液面相平,原因是金属均有剩余,加入等质量、等质量分数的稀盐酸,充分反应后生成的 H2 质量相等。【探究三】在硫酸铜和硫酸亚铁的混合溶液中加入一定量的镁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,没有气泡产生,铁和镁均可与稀硫酸反应生成氢气,说明滤出的固体中没有铁和镁,滤出的固体中一定含有铜,滤液中可能含有硫酸铜,滤液中一定含有硫酸镁和硫酸亚铁。发生反应的化学方程式是Fe+ HCl = H2↑+ FeCl2。
点睛∶镁,铁的活动性均在 H 之前并且镁比铁活泼,镁和铁均可与盐酸或硫酸反应;也可通过产生气体快慢,判断金属活动性强弱。