题目内容
【题目】含有铁粉5.6g、铜粉3.2g、镁粉2.4g的混合物,与一定质量的稀硫酸充分反应,反应停止后,有6g固体剩余。下列说法错误的是
A. 剩余固体中有镁粉和铜粉 B. 镁粉先和稀硫酸反应
C. 稀硫酸一定没有剩余 D. 反应共生成氢气0.3g
【答案】A
【解析】
根据金属性活动顺序表,活动性顺序:镁>铁>氢>铜,根据Cu的金属活动性在(H)之后,不能与稀硫酸发生置换反应,所以剩余的6克固体里肯定有全部的铜;除了铜外还剩2.8g固体应该是铁,因为镁的活动性比铁强,所以酸先与镁反应。反应停止后,有6g固体剩余,故剩余混合物中有铜粉3.2g,铁粉(6g-3.2g)=2.8g。故2.4克镁、5.6g-2.8g=2.8克铁和硫酸完全反应了。根据反应的化学方程式和参与反应的镁、铁的质量,计算出各自产生氢气的质量,然后再求出共产生氢气的质量。
A、镁活泼先与硫酸反应,所以剩余固体中不存在镁粉,故选项正确;
B、镁活泼先与硫酸反应,故选项错误;
C、铁有剩余,所以稀硫酸一定没有剩余,故选项错误;
D、根据题意可知,有2.4g镁、2.8g铁和硫酸完全反应了;
设镁与硫酸反应生成氢气质量为x,铁与硫酸反应生成氢气质量为y

根据:![]() =
=![]() ,
,![]() =
=![]()
解得:x=0.2g,y=0.1g,所以生成氢气的总质量:0.2g+0.1g=0.3g,故选项错误。故选A。

 阅读快车系列答案
阅读快车系列答案【题目】化学学习小组在实验室里加热高锰酸钾制取氧气,反应过程中测得剩余固体质量与加热时间关系如图所示.请计算:
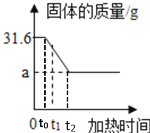
(1)理论上制得氧气的质量___________;
(2)图像中a的数值为_________________;
(3)时间为t1时固体中锰元素的质量_________g;
(4)反应后固体中MnO2的质量分数为__________;(精确到0.01%)
(5)以下是几种药品的价格,现实验室要制取96g氧气,请问用哪种药品会比较划算?___________
药品 | 高锰酸钾 | 氯酸钾 | 双氧水(30%) |
价格(元)/kg | 113.4 | 84 | 54 |
【题目】如表是甲、乙、丙三种物质的部分溶解度 (单位:g),请回答。
温度 (℃) | 10 | 20 | 30 | 40 | 50 | 60 |
甲 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
乙 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
丙 | 0.182 | 0.165 | 0.160 | 0.141 | 0.132 | 0.121 |
①10℃时,甲物质的溶解度是_____g;
②三种物质中溶解度受温度影响较大的是_____;
③物质在20℃的溶解性与其溶解度关系示意图如图所示,则丙物质的溶解性是_____;

④30℃时,三种物质的溶解度由大到小的顺序是_____;
⑤50℃时,三种物质饱和溶液的溶质质量分数最大的是_____。