题目内容
【题目】如图是氯化铵和氯化钠两种固体物质的溶解度曲线,下列叙述错误的是
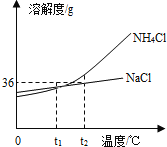
A.![]() 时,NaCl和
时,NaCl和![]() 两种物质各自的溶液中,所含溶质的质量分数相等
两种物质各自的溶液中,所含溶质的质量分数相等
B.![]() 时,
时,![]() 的溶解度大于NaCl的溶解度
的溶解度大于NaCl的溶解度
C.![]() 时,向18gNaCl固体中加入50g水,充分搅拌后固体能全部溶解,形成氯化钠的饱和溶液
时,向18gNaCl固体中加入50g水,充分搅拌后固体能全部溶解,形成氯化钠的饱和溶液
D.![]() 中含有少量NaCl,可以用冷却热饱和溶液的方法提纯
中含有少量NaCl,可以用冷却热饱和溶液的方法提纯![]()
【答案】A
【解析】
A、t1℃时,NaCl和NH4C1两种物质的溶解度相等,但是溶液的状态不能确定,所以所含溶质的质量分数不能确定,故A错误;
B、通过分析溶解度曲线可知,t2℃时,NH4Cl的溶解度大于NaCl的溶解度,故B正确;
C、t2℃时,氯化钠的溶解度等于36g,所以向18gNaCl固体中加入50g水,充分搅拌后固体刚好能全部溶解,形成氯化钠的饱和溶液,故C正确;
D、氯化铵的溶解度受温度变化影响较大,所以NH4Cl中含有少量NaCl,可以用冷却热饱和溶液的方法提纯NH4Cl,故D正确。
故选:A。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案【题目】化学链燃烧是新的燃烧概念,即燃料不直接与空气接触燃烧,而是以载氧体(如CaSO4等)在两个反应器之间的循环来实现燃料的燃烧过程(如图1)。请回答下列问题:
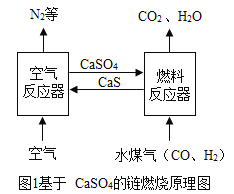
(1)空气反应器中主要发生化合反应,化学方程式为_____。燃料反应器中, CO与CaSO4发生的反应方程式为 。
。
(2)实验室模拟CO与石膏(CaSO4﹒2H2O)的反应,并测定CO与石膏(CaSO4﹒2 H2O)是否反应完全,设计装置如图2。
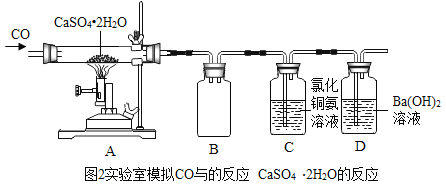
①广口瓶B的作用是_____。C中反应的化学方程式为![]() _____
_____![]() ,C装置的作用是_____,该实验的尾气无毒。
,C装置的作用是_____,该实验的尾气无毒。
②完成实验报告(已知:热的CaS会跟氧气反应;氯化亚铜和氨水混合溶液为无色)。
实验步骤 | 现象 | 分析与解释 |
检查气密性并装填好药品后,首先应先通一会CO | C中_____(填反应现象) | |
点燃A处酒精喷灯 | D中_____(填反应现象) | |
停止加热,继续通一会CO,直到装置冷却 | 继续通CO目的:(1)使生成的CO2全部被氢氧化钡溶液吸收; (2)_____ | |
取A中残留固体,加足量稀盐酸 | _____(填反应现象),有少量不溶物 |
|
(3)若所取石膏样品(CaSO4﹒2 H2O)质量为1.00g,装置D中产生的BaCO3的质量为3.94g,求石膏样品的转化率。_____(转化率:![]() ,己知BaCO3的相对分子质量为197)(写出计算过程)
,己知BaCO3的相对分子质量为197)(写出计算过程)
(4)D装置中不宜使用澄清石灰水的理由是_____。