题目内容
【题目】“用微观的眼光看世界”是学习化学的重要方法。请按要求填空。
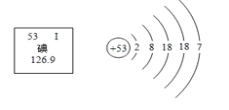
⑴食用加碘盐中加入的物质是碘酸钾(KIO3),该物质中属于常量元素的有_______(填元素名称),碘元素的相关信息和原子结构如右图所示,则碘元素的相对原子质量是_______,碘在元素周期表中位于第______周期;烹饪时不宜过早加入食盐是因为碘酸钾受热不稳定,易分解生成碘化钾和氧气,请写出该反应的化学方程式_______。
⑵若“![]() ”表示一个氯原子,则“
”表示一个氯原子,则“![]()
![]() ”表示__(填化学用语);
”表示__(填化学用语);
⑶表示出氧化铝中铝元素的化合价_______(填化学用语)。
⑷NH4Cl溶液与KOH溶液能够反应,其实质是因为它们在水中解离出来的NH4+和OH-结合生成了NH3和H2O。结合发生复分解反应的条件,请回答:盐酸与硝酸银溶液能够反应的实质是它们在水中解离出_______(填离子符号)结合生成了_______。
【答案】钾、氧 126.9 五 ![]() 2Cl2
2Cl2 ![]() Ag+和Cl- AgCl
Ag+和Cl- AgCl
【解析】
(1)食用加碘盐中加入的物质是碘酸钾中属于常量元素的有钾元素和氧元素;根据碘元素的相关信息和原子结构图,可知碘元素的相对原子质量是 126.9;原子的电子层数等于所在周期数;碘在元素周期表中位于第五周期;碘酸钾受热分解生成碘化钾和氧气:![]() ;
;
(2)若“![]() ”表示一个氯原子,则“
”表示一个氯原子,则“![]()
![]() ”表示氯气分子;
”表示氯气分子;
(3)元素化合价的表示方法:确定出化合物中所要标出的元素的化合价,然后在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,所以氧化铝中铝元素的化合价,故可表示为![]() ;
;
(4)盐酸与硝酸银溶液能够反应的实质是它们在水中解离出的Ag+和Cl-结合成AgCl沉淀。

【题目】李呈同学想通过实验,探究某企业用氨碱法生产纯碱样品的成分及含量.
(提出问题)该纯碱样品中含有哪些物质?
(猜想与假设)通过分析,李呈同学做出如下假设:(1)只含有Na2CO3;(2)含有Na2CO3和NaHCO3
(查阅资料)
NaHCO3 | Na2CO3 | |
加入稀盐酸 | 现象I | 产生气泡 |
加入饱和石灰水 | 溶液变浑浊 | 现象Ⅱ |
加入CaCl2溶液 | 无明显现象 | 溶液变浑浊 |
加热溶液至沸腾,将气体通入澄清石灰水 | 澄清石灰水变浑浊 | 澄清石灰水无明显变化 |
(1)表中的现象I为________________;
(2)现象Ⅱ对应的化学方程式为____________________.
(实验探究)为了确定纯碱样品的成分,李呈同学设计如下实验方案,请你一起完成下列实验报告.
实验步骤 | 实验现象 | 实验结论及化学方程式 |
A取少量样品溶于水,加入过量的CaCl2溶液 | ①_________________ | 该反应的方程式:②___________ |
B将上述反应后的混合液过滤,取滤液③ _______________ | ④________________ | 证明猜想②成立 |
(注意:正确回答下列问题加4分,总分不超过60分)
(实验反思)实验步骤A中,氯化钙溶液过量的目的是____________.
(提出问题2)如何测量该纯碱样品中各物质的含量?
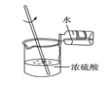
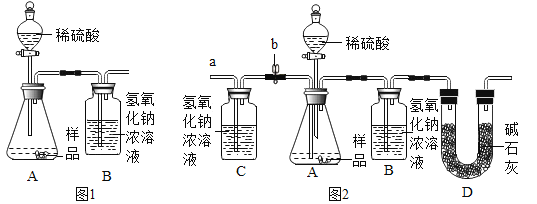
(1)为测量该纯碱样品各成分的含量,毕倭寇同学设了图1装置,通过称量B装置中质量变化来确定样品中各成分的含量.该装置气密性良好,稀硫酸与样品、进入装置B的CO2与NaOH均完全反应,操作无误,但多次实验发现,测定结果有偏差.造成偏差的原因有①__________;②______________(2)李呈同学在老师的指导下重新设计了如图2所示的实验装置.该实验有以下操作步骤:
①查装置气密性,将Wg干燥的样品放入锥形瓶中;
②称量盛有氢氧化钠浓溶液的B瓶质量;
③打开活塞b,从导管a处缓缓鼓入一定量的空气,关闭活塞b;
④向锥形瓶中逐滴加入稀硫酸至不再产生气泡;
⑤再次称量盛有氢氧化钠浓溶液的B瓶质量;
⑥打开活塞b从导管a处缓缓鼓入一定量的空气,关闭活塞b;
⑦根据B瓶增加的质量,计算样品中各成分的含量.该实验的正确步骤是________________.
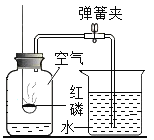
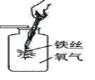
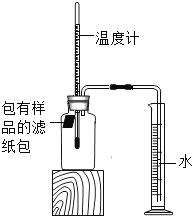
【题目】小明对铁的锈蚀进行如下探究,室温时,将包有样品的滤纸包用大头针固定在橡胶塞上,迅速塞紧,装置如图,观察到量筒内水沿导管慢慢进入广口瓶(净容积为146mL)。当温度恢复至室温,且量筒内水面高度不变时读数(此时瓶内氧气含量近似为零)。记录起始和最终量筒的读数以及所需时间如表。
序号 | 样品 | 量筒起始 读数/mL | 量筒最终 读数/mL | 所需时间 /min |
1 | 1g铁粉、0.2g碳和10滴水 | 100 | 70 | 约120 |
2 | lg铁粉、0.2g碳、10滴水和少量NaCl | 100 | 70 | 约70 |
3 | …… | 100 | 70 | 约480 |
(1)实验①和②说明NaCl可以_____铁锈蚀的速率。
(2)实验开始后,广口瓶内温度有所上升,说明铁的锈蚀过程是_____(填“放热”或“吸热”)过程。
(3)实验结束后取出滤纸包,观察到有红棕色物质生成,该物质的化学式是_____。
(4)已知含碳能够加快铁的生锈速度,小明想通过实验①和③是探究碳对铁锈蚀速率的影响,请在表格空白处填写实验③的样品组成_____。
(5)该装置还可用于测量空气中氧气的含量,根据上述数据计算氧气的体积含量是_____(小数点后保留1位)。
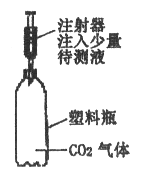
【题目】实验室有两瓶标签破损的无色溶液甲、乙,只知道它们分别是稀盐酸和氢氧化钠溶液。请同学设计不同方案区别它们。按要求回答下列问题:
(1)在不选用酸碱指示剂、pH试纸的情况下,选择不同类别的物质进行区分。
所加试剂 | 实验现象和结论 | 发生反应的化学方程式 | |
方法一 | 锌粒 | 有气泡产生的是稀盐酸,无气泡产生的是氢氧化钠溶液 | Zn+2HCl=ZnCl2+H2↑ |
方法二 |
(2)同学们在交流实验方案时,小刚设计的“用二氧化碳气体做试剂”引起了一场争论。正方观点:可以区别;反方观点:无法区别。小明赞同反方的观点,其理由是_______________;小红则赞同正方的观点,如果你也赞同的话,请你参考下图装置说出验证的方法(简要写出操作、现象、结论):__________________。