题目内容
【题目】在探究金属的活动性顺序时,某同学将一定质量的Zn粉放入AgNO3与Cu(NO3)2的混合溶液中,实验流程如图所示,请分析回答:
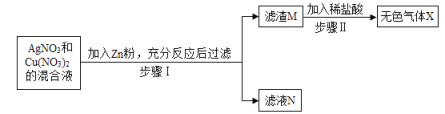
(1)步骤Ⅱ中生成的无色气体X是_____,该反应的基本反应类型是_____.
(2)滤液N中的溶质是_____;生成该溶质的化学方程式_____________。
【答案】氢气 置换反应 硝酸锌 Zn+2AgNO3═Zn(NO3)2+2Ag、Zn+Cu(NO3)2═Zn(NO3)2+Cu
【解析】
由于金属的活动性是:锌>铜>银,将一定质量的Zn粉放入AgNO3与Cu(NO3)2的混合溶液中,锌先与硝酸银反应生成了银和硝酸锌,当硝酸银完全反应后,再与硝酸铜反应生成了硝酸锌和铜。由流程图可知,向过滤后的滤渣中加稀硫酸有气泡生成,说明了锌粉是过量的,生成的无色气体应为氢气,溶液中的硝酸银和硝酸铜完全发生了反应,所以:
(1)步骤Ⅱ中生成的无色气体X是氢气,该反应锌与稀硫酸反应生成了硫酸锌和氢气,基本反应类型是由一种单质和一种化合物生成另一种单质和另一种化合物的置换反应;
(2)因硝酸铜和硝酸银完全反应,滤液N中的溶质只有生成的硝酸锌;所发生的反应的化学方程式有:Zn+2AgNO3═Zn(NO3)2+2Ag、Zn+Cu(NO3)2═Zn(NO3)2+Cu。

练习册系列答案
相关题目