题目内容
【题目】在学习过程中,小青同学提出一个问题:“碳燃烧时可能生成CO2,也可能生成CO,那么碳与氧化铜反应生成的气体可有多种可能?”
【猜想】碳与氧化铜反应生成的气体中:①只有CO2,则发生的化学方程式是 ;②只有 ;③既有CO,又有CO2.
【查阅资料】浸有磷钼酸的氯化钯试纸遇CO2无变化,但遇到微量CO立即变成蓝色.
【方案设计】通过上述资料和已有知识,小青初步设想用浸有磷钼酸溶液的氯化钯试纸和澄清的石灰水对碳与氧化铜反应生成的气体进行检查.
【实验验证】经过思考之后,小青设计了如图实验装置.
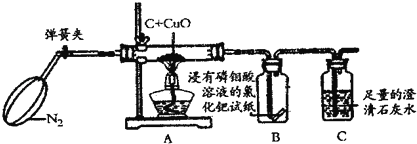
【实验步骤】
(1)打开弹簧夹,先通一会儿纯净、干燥的N2,通一会儿N2的目的是 ;
(2)关闭弹簧夹,点燃酒精灯加热.
【结论】充分反应后,小青观察到:试纸 ,石灰水 ,证明猜想③是正确的,A中可能观察到的现象 .
【定量计算】小青称取一定量的碳和氧化铜的混合物,充分反应后,测得装置A质量减少了1.44g,装置C质量增加了0.88g,计算参加反应的氧化铜的质量为 g.
【反思与评价】从环保的角度分析该实验装置中不完善之处是 .
【答案】【猜 想】C+2 CuO![]() 2 Cu+CO2↑,CO
2 Cu+CO2↑,CO
【实验步骤】(1)除去装置内空气,排除干扰.
【结 论】变蓝,变浑浊,有红色物质生成.
【定量计算】4.8.
【反思与评价】没有尾气处理(吸收)装置.
【解析】【猜想】①在高温的条件下,碳与氧化铜反应生成铜和二氧化碳;
②根据题干信息分析可知,可能只生成一氧化碳,故填:CO;
【实验步骤】要排除空气的影响,故氮气的作用是排出装置内的空气;故填:排尽装置中的空气;
【结论】反应生成的气体中既有CO,又有CO2,则试纸变蓝色,石灰水变浑浊.碳与氧化铜在高温的条件下反应生成物中有铜,故填:变成蓝色;变浑浊;黑色固体变成红色;
【定量计算】装置C增重的质量就是吸收的二氧化碳的质量,即0.88g,
设生成二氧化碳时,参加反应的氧化铜的质量为x,
C+2CuO![]() 2Cu+CO2↑;
2Cu+CO2↑;
160 44
x 0.88g
![]()
解得:x=3.2g
生成一氧化碳的质量为1.44g﹣0.88g=0.56g
设生成一氧化碳时,参加反应的氧化铜的质量为y,
C+CuO![]() Cu+CO↑;
Cu+CO↑;
80 28
y 0.56g
![]()
y=1.6g
参加反应的氧化铜的质量为3.2g+1.6g=4.8g.
【反思与评价】CO有毒,不能排放到空气中,需处理剩余的CO,故填:没有进行尾气处理.

【题目】如图1是“空气中氧气体积分数测定”实验的改进装置.主要操作是:在实际容积为150mL的集气瓶里,先装进50mL的水,再按图1连好仪器,按下热的玻璃棒,白磷立即被点燃.(白磷40℃即燃烧,燃烧产物与红磷相同)

(1)白磷从燃烧到熄灭冷却的过程中,瓶内水面的变化是 ;若实验成功,最终集气瓶中水的体积约为 mL.
(2)该实验可推论出氮气的性质为 .
(3)若将白磷换成炭粉,该实验能否获得成功?为什么? .
(4)集气瓶里预先装进的50mL水,在实验过程中起到哪些作用?(填写序号)
A.加快集气瓶内气体冷却 B.液封导气管末端以防气体逸出 C.吸收五氧化二磷
(5)图2是另一实验小组对测定空气中氧气含量实验的两套装置图,请结合图示回答有关问题.(已知铜和氧气在加热的条件下反应生成氧化铜固体)
①根据下表提供的实验数据,完成如表
硬质玻璃管中空气的体积 | 反应前注射器中空气体积 | 反应后注射器中气体体积 | 实验测得空气中氧气的体积分数 |
25mL | 15mL | 9mL |
②装置一和装置二中气球的位置不同, (填“装置一”或“装置二”)更合理,理由是 .
③若实验测得的结果偏小(氧气的体积分数小于21%),可能的原因有哪些? (列举两条).
