题目内容
【题目】在一烧杯中盛有42.2gCaCO3和CaCl2的粉末状混合物,向其中264.6g水,使混合物中的可溶物完全溶解.然后再向其中逐滴加如溶质的质量分数为10%的稀盐酸,烧杯中难溶固体物质的质量与所滴入稀盐酸的质量关系曲线如图所示.请根据题意回答下列问题: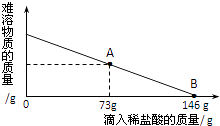
(1)在滴入稀盐酸的过程中,观察到的明显现象是:
①
②
(2)当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是(写化学式).
(3)当滴入10%的稀盐酸146g时(即B点),试通过计算,求此时烧杯中所得不饱和溶液的溶质质量分数.
【答案】
(1)固体物质不断溶解,有气体产生(或有气泡冒出)
(2)CaCl2
(3)10%
【解析】:(1)在滴入稀盐酸的过程中,碳酸钙和稀盐酸不断反应,观察到固体溶解,产生气泡;
所以答案是:固体溶解;产生气泡;
(2)当滴入10%的稀盐酸至图中A点时,烧杯中溶液里含有的溶质是原混合物中的氯化钙和反应生成的氯化钙;
所以答案是:CaCl2;
(3)当滴入10%的稀盐酸146g时(即B点),碳酸钙与稀盐酸恰好反应,设反应掉的碳酸钙的质量为x,生成氯化钙的质量为y,生成二氧化碳的质量为w
CaCO3+ | 2HCl═ | CaCl2+H2O+ | CO2↑ |
100 | 73 | 111 | 44 |
x | 146g×10% | y | w |
![]() =
= ![]() 解得x=20g,则混合物中CaCl2 的质量为:42.2g-20g=22.2g
解得x=20g,则混合物中CaCl2 的质量为:42.2g-20g=22.2g
![]() =
= ![]() 解得y=22.2g
解得y=22.2g
![]() =
= ![]() 解得 w=8.8g
解得 w=8.8g
烧杯中所得不饱和溶液的质量为:42.2g+264.6g+146g-8.8g= 444g,溶质的质量为:22.2g+22.2g=44.4g,故所得不饱和溶液的溶质质量分数为: ![]() ×100%=10%;
×100%=10%;
所以答案是:10%;
【考点精析】掌握根据化学反应方程式的计算是解答本题的根本,需要知道各物质间质量比=系数×相对分子质量之比.