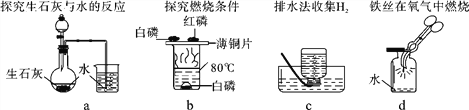
题目内容
【题目】如图中表示中学几种常见的物质在一定条件下可以转化,A是石灰石的主要成分,D是澄清石灰水的主要成分,C和F是组成元素相同的气体,E、G为黑色的粉末,H为紫红色固体。(部分条件省略)
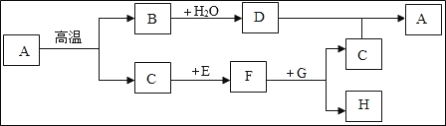
(1)写出下列物质的化学式:A_____、G_____。
(2)写出下列反应的化学方程式:
A→B+C:_____;C→F:_____。
(3)物质C在生活中的一种用途_____。
【答案】![]() CuO CaCO3
CuO CaCO3![]() CaO+CO2↑ CO2+C
CaO+CO2↑ CO2+C![]() 2CO 制冷剂、人工降雨、气体肥料、灭火剂
2CO 制冷剂、人工降雨、气体肥料、灭火剂
【解析】
解:![]() 根据A是石灰石的主要成分,所以A是碳酸钙,A在高温条件下会生成氧化钙和二氧化碳,所以B是氧化钙,C和F是组成元素相同的气体,C在黑色固体E的作用下生成气体F,所以C为二氧化碳,F为一氧化碳,E为碳,碳和二氧化碳高温条件下反应生成一氧化碳,水和氧化钙反应产生D,因此D是氢氧化钙,氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水; G为黑色的粉末, 一氧化碳和G反应产生二氧化碳和H,H为紫红色固体,一氧化碳和氧化铜反应产生铜和二氧化碳,因此G为氧化铜,H为铜,故A、G化学式分别为:
根据A是石灰石的主要成分,所以A是碳酸钙,A在高温条件下会生成氧化钙和二氧化碳,所以B是氧化钙,C和F是组成元素相同的气体,C在黑色固体E的作用下生成气体F,所以C为二氧化碳,F为一氧化碳,E为碳,碳和二氧化碳高温条件下反应生成一氧化碳,水和氧化钙反应产生D,因此D是氢氧化钙,氢氧化钙和二氧化碳反应产生碳酸钙沉淀和水; G为黑色的粉末, 一氧化碳和G反应产生二氧化碳和H,H为紫红色固体,一氧化碳和氧化铜反应产生铜和二氧化碳,因此G为氧化铜,H为铜,故A、G化学式分别为:![]() ;CuO;
;CuO;
![]() 碳酸钙高温分解生成氧化钙和二氧化碳,反应的化学方程式CaCO3
碳酸钙高温分解生成氧化钙和二氧化碳,反应的化学方程式CaCO3![]() CaO+CO2↑;二氧化碳和碳在高温下反应生成一氧化碳,反应的化学方程式为CO2+C
CaO+CO2↑;二氧化碳和碳在高温下反应生成一氧化碳,反应的化学方程式为CO2+C![]() 2CO;
2CO;
![]() 二氧化碳的用途是制冷剂、人工降雨、气体肥料、灭火剂。
二氧化碳的用途是制冷剂、人工降雨、气体肥料、灭火剂。

【题目】某兴趣小組为测定石灰石中碳酸钙的质量分数,取12g石灰石样品加入烧杯中,将120g稀盐酸平均分四次加入,充分反应后(杂质不溶于水也不与稀盐酸反应),测得实验数据如下:
实验次数 | 第一次 | 第二次 | 第三次 | 第四次 |
加入稀盐酸的质量/g | 30 | 30 | 30 | 30 |
剩余固体的质量/g | 9 | 6 | 3 | 2 |
分析数据计算(結果精确到0.1%):
(1)该祥品中碳酸钙的质量分数为__________。
(2)所用稀盐酸的溶质质量分数为__________。
(3)12g样品中的碳酸钙恰好完全反应时所得溶液的溶质质量分数为__________。