题目内容
【题目】(14分)小组同学查资料知道泡沫灭火器原理是:AlCl3+3NaHCO3=3NaCl +Al(OH)3↓+3CO2↑
【提出问题】此反应发生的原因是是否由于AlCl3呈酸性?
【实验】测定AlCl3溶液的酸碱性
(1)用 测定溶液的酸碱性。
【提出问题】NH4Cl溶液呈酸性,它是否也能与NaHCO3溶液反应?
【实验】按下图进行实验:
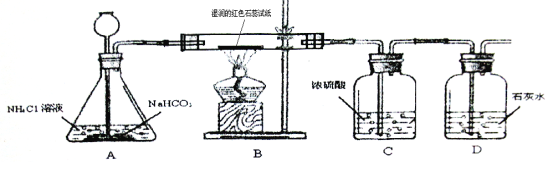
观察到的现象是:湿润的红色石蕊试纸变蓝,石灰水变浑浊
(2)说明生成的气体有 和
(3)C中浓硫酸吸收水蒸气和 。
(4)A中的反应方程式是 。
【实验反思】Ⅰ、Na2CO3和 NaHCO3 的性质区别
按下图进行实验:
取适量的NaHCO3 粉末加到a试管中,加热,观察到a试管口有水生成,b试管中澄清石灰水变浑浊。持续加热直至两试管均不再发生变化时,发现a试管中仍残留有较多白色固体粉末。
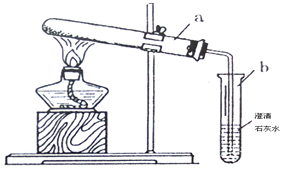
(5)小文猜测白色固体粉末可能是:①NaOH;②Na2CO3;③NaCl.小燕认为猜想③一定不正确,理由是 ,小燕从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,她判断该固体为NaOH,小美认为她的实验设计不合理,因为 。
(6)他们继续探究固体成分,设计了如下实验:
操作步骤 | 实验现象 | 结论 |
取少量白色固体于试管中,加水溶解,向其中滴加足量 溶液, | 剩余的固体有Na2CO3 | |
静置,继续滴加酚酞 | 不变红 | 剩余的固体没有NaOH |
通过实验证明:2NaHCO3 ![]() Na2CO3+ CO2↑ + H2O, NaHCO3热稳定性较Na2CO3差。
Na2CO3+ CO2↑ + H2O, NaHCO3热稳定性较Na2CO3差。
Ⅱ、泡沫灭火器中应用
按下图进行实验:U型管中分别加入等质量碳酸钠和碳酸氢钠固体,在两支注射器中分别吸入同溶质质量分数、同体积的足量稀盐酸,然后同时迅速将盐酸分别注入U型管中。
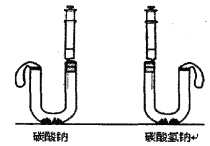
(7) 边U型管乳胶套膨胀更大,等质量碳酸钠和碳酸氢钠与盐酸反应生成的气体质量比是 ,由此可知泡沫灭火器中用NaHCO3 ,不用Na2CO3的原因 。
Ⅲ、碳酸钠样品中碳酸钠的质量分数测定
(8)有一样品含有碳酸钠和碳酸氢钠,为了测定其中碳酸钠的含量,取样品10g,加热到质量不再减少,称得剩余固体质量为6.9g ,求样品中碳酸钠的质量分数 。
【答案】(1)PH试纸或紫色石蕊试液
(2)CO2 和 NH3
(3)NH3
(4)NH4Cl + NaHCO3 = NaCl + NH3↑+ CO2↑+ H2O
(5)NaHCO3中不含氯元素或不符合质量守恒定律等 Na2CO3溶液呈碱性或若是Na2CO3也有此现象
(6)CaCl2 或 BaCl2或Ca(N O3)2或 Ba(NO3)2 产生白色沉淀
(7)右 42/53 等质量的碳酸氢钠产生的二氧化碳多
(8)16%
【解析】
试题分析:(1)测定溶液的酸碱性可用PH试纸或紫色石蕊试液
(2)湿润的红色石蕊试纸变蓝,说明生成了NH3,石灰水变浑浊,说明生成了CO2
(3)氨气溶于水得到氨水,显碱性,故 C中浓硫酸吸收水蒸气和NH3
(4)根据上面的探究,可知反应生成氨气、二氧化碳及水,故A中的反应方程式是:NH4Cl + NaHCO3=NaCl + NH3↑+ CO2↑+ H2O
(5)猜想③一定不正确,理由是NaHCO3中不含氯元素或不符合质量守恒定律等;小燕从试管内取少量白色固体溶于水,滴加酚酞,溶液变红,她判断该固体为NaOH,小美认为她的实验设计不合理,因为:Na2CO3溶液呈碱性或若是Na2CO3也有此现象
(6)要证明溶液中既有Na2CO3,又有NaOH,应先证明并除去Na2CO3,然后再来通过检验溶液的酸碱性来证明NaOH是否存在,故操作步骤:取少量白色固体于试管中,加水溶解,向其中滴加足量的CaCl2 或 BaCl2或Ca(N O3)2或 Ba(N O3)2 溶液,(注意不能加入酸或碱,因为都会影响NaOH的检验),实验现象 :产生白色沉淀,证明含有Na2CO3
(7)根据化学反应:Na2CO3+2HCl==2NaCl+H2O+CO2↑中Na2CO3与CO2的质量关系为106:44,NaHCO3+HCl==NaCl+H2O+CO2↑中NaHCO3与CO2的质量关系为84:44,意味着相同质量的Na2CO3、NaHCO3,NaHCO3产生的二氧化碳质量更大,故右边U型管乳胶套膨胀更大;等质量碳酸钠和碳酸氢钠与盐酸反应生成的气体质量比=84/106=42/53;由此可知泡沫灭火器中用NaHCO3 ,不用Na2CO3的原因:等质量的碳酸氢钠产生的二氧化碳多
(8)根据质量守恒定律,可判断反应产生的二氧化碳和水的总质量=10g -6.9g=3.1g,然后根据化学方程式:2NaHCO3 △Na2CO3+ CO2↑ + H2O中NaHCO3与CO2和水的质量关系,可先计算出NaHCO3的质量,然后计算样品中碳酸钠的质量分数
解:设NaHCO3的质量为x
2NaHCO3 △Na2CO3+ CO2↑ + H2O
168 62
x 3.1g
168:62=x:3.1g
x=8.4g
故样品中碳酸钠的质量分数=(10g-8.4g)/10g×100%=16%