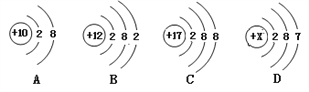
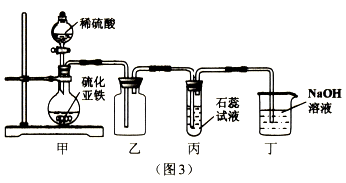
题目内容
【题目】下列说法中,正确的是( )
A. 质量和质量分数均相等的氢氧化钠溶液和稀硫酸充分反应,所得溶液呈碱性
B. 在密闭容器中,7.2g 碳与一定量氧气恰好完全反应,生成气体的质量可能是 16.6g
C. 100g 稀盐酸与一定量的碳酸钙恰好完全反应,测得所得溶液质量为 111g,稀盐酸中溶质质量分数是 18.25%
D. CO 与 CO2 混合气体 10g 与足量 O2 反应后,所得气体的质量比原来多 4g,则原混合气体中 CO2的质量分数是 30%
【答案】AD
【解析】A、质量相等、溶质质量分数也相同的氢氧化钠溶液和硫酸溶液中,硫酸与氢氧化钠的质量相等。反应中消耗硫酸与氢氧化钠的质量比关系如下:
H2SO4+2NaOH=Na2SO4+2H2O
98 80
可以看出98份质量的硫酸与80份质量的氢氧化钠恰好完全反应,则等质量的硫酸与氢氧化钠混合后,氢氧化钠有剩余,溶液显碱性,正确;
B、设7.2g碳在氧气中完全燃烧生成二氧化碳的质量为x
C+O2![]() CO2
CO2
12 44
7.2g x
12/7.2g=44/x x=26.4g
再假设7.2g碳在氧气中不充分燃烧产生的一氧化碳的质量为y
2C + O2![]() 2CO
2CO
2456
7.2g y
24/7.2g=56/y y=16.8g
7.2克碳和一定量的氧气完全反应生成的气体的质量应该在16.8g ~ 26.4g范围内,错误;
C、设盐酸中溶质的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O 溶液的质量增加
73 100-44
x 111g-100g
73/x=(100-44)/( 111g-100g) x≈14.34g
稀盐酸中溶质质量分数是14.34g÷100g×100%=14.34%<18.25%,错误;
D、二氧化碳不能与氧气反应,一氧化碳与氧气反应生成二氧化碳,反应后气体的质量比原来增加了4g,增加的质量就是参加反应氧气的质量。
设混合气体中一氧化碳的质量为x,
2CO + O2![]() 2CO2
2CO2
56 32
x4g
56/x=32/4g
x=7g;
则混合气体中二氧化碳的质量为:10g-7g=3g;
则原混合气体中CO2的质量分数为=3g÷10g×100%=30%。故选AD。

【题目】(1)下列实验现象的描述正确的是(______)(多选,用字母作答)
A. 将燃烧的木条伸入人体呼出的气体中,木条燃烧更旺
B.一氧化碳在空气中燃烧,产生蓝色火焰
C.将一根打磨过的铁丝伸入硫酸铜溶液中,铁丝表面有红色固体析出
D. 向滴有酚酞的NaOH溶液中逐滴滴加稀盐酸,溶液由无色变为红色
E. 将一枚生锈的铁钉浸入稀盐酸中片刻,溶液变为浅绿色
(2)请从下列甲乙两题中任选一题作答。
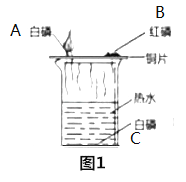
试题甲:探究燃烧的条件 | 试题乙:探究二氧化碳的性质 |
|
|
实验过程,能观察到燃烧现象的是 _____,(填序号),热水的作用是 _____和隔绝氧气,实验方法为控制变量法,就白磷而言,控制的变量为____。 | 实验过程中观察到,干石蕊纸花喷水后放入二氧化碳中,纸花的颜色会____ ,反应的化学方程式为____,实验方法为控制变量法,本实验控制的变量为 ______。 |