题目内容
某农民种植的小麦植株矮小,叶色发黄.根据所学的化学知识请你为他选择一种化肥(选氮肥、磷肥、钾肥),就使用化肥的利与弊分别谈谈你的观点(各答一点即可).
氮肥;
使用化肥的利处:促进粮食的增产;使用化肥的弊处:容易造成土壤污染、水体污染、农产品污染等.
解析试题分析:氮肥能使农作物枝叶繁茂、叶色浓绿、提高产量;某农民种植的小麦植株矮小,叶色发黄,说明土壤中缺乏氮元素,因此选氮肥;
使用化肥的利处:促进粮食的增产;
使用化肥的弊处:容易造成土壤污染、水体污染、农产品污染等.
考点:常见化肥的种类和作用
点评:解答本题要充分理解物质对人类有利的一面和不利的一面,只有这样才能对相关方面的问题做出正确的判断.

练习册系列答案
 活力试卷系列答案
活力试卷系列答案 课课优能力培优100分系列答案
课课优能力培优100分系列答案
相关题目
(1)请你与小明和他的同学一起进行实验室制取二氧化碳的探究。
小明对三组药品进行了研究,实验记录如下:
| 组别 | 药品 | 实验现象 |
| ① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
| ② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
| ③ | 碳酸钠粉末和稀盐酸 | 产生气泡速率很快 |
(2)老师为他们提供的如下图所示的实验仪器(导管、橡皮塞等未画出)。

小明根据提供的实验仪器分别设计了下列四套制取和收集二氧化碳的装置。

对上面的设计方案小明和他的同学进行了交流讨论。
其中可能收集不到二氧化碳气体的装置是 ;能够使反应随时停止和发生的装置是 。用澄清石灰水可鉴定CO2气体,请写出其化学方程式为 。
【反思小结】
气体制取和收集装置的选择依据

某实验小组利用废硫酸液制备K2SO4并研究CaSO4?2H2O加热分解的产物.
(一)K2SO4的制备
(1)将CaCO3研成粉末的目的是 .
(2)上述流程中可循环使用的物质有CO2和 (填写化学式).
(3)反应Ⅲ中相关物质的溶解度如下表.你认为反应Ⅲ在常温下能实现的原因是 .
| 物质 | KCl | K2SO4 | NH4Cl | M |
| 溶解度/g(25℃) | 34.0 | 11.1 | 37.2 | 19.5 |
(4)不用水而用饱和K2SO4溶液洗涤反应Ⅲ所得晶体的目的是 ;为检验此晶体是否洗涤干净,可取最后一次洗涤液,先加入 (选填序号,下同),振荡、静置,再向上层清液中滴加 ,观察现象即可判断.
a.AgNO3溶液 b.过量的BaCl2溶液 c.过量的Ba(NO3)2溶液
(二)研究CaSO4?2H2O加热分解的产物.
(5)分离所得的CaSO4?2H2O含有CaCO3,可用盐酸除去,该的化学反应方程式 .
(6)为了测定CaSO4?2H2O和CaCO3的质量比x:y,实验小组利用如图所示的装置(夹持仪器省略)进行实验.
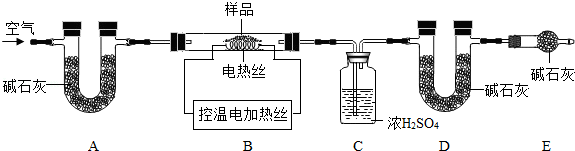
①实验前首先要 ,再装入样品.装置A的作用是 .
②已知CaSO4?2H2O在160℃生成CaSO4,1350℃时CaSO4开始分解;CaCO3在900℃时分解完全.现控制B装置温度900℃进行实验并采集了如下数据:
a.反应前玻璃管与样品的质量m1g b.反应后玻璃管中固体的质量为m2g
c.装置C实验后增重m3g d.装置D实验后增重m4g
某同学选用b、d或c、d数据组合求出x:y的值,若无装置E,则实验测定结果将 (填“偏大”、“偏小”或“无影响”).你认为还可选用上述的 (选填序号)两个数据组合也可求出x:y的值.
(7)CaSO4?2H2O受热会逐步失去结晶水.取纯净CaSO4?2H2O固体3.44g,放在(5)的实验装置B中进行加热,测定固体质量随温度的变化情况如图所示.①G点固体的化学式是 .

②将T2~1400℃温度段加热固体所产生的气体通入酸性KMnO4溶液中,溶液褪色,则H~I段发生反应的化学方程式为 .
根据下表数据,回答下列问题.
| 物质 | 厕所清洁剂 | 白醋 | 食盐水 | 洗涤剂 | 炉具清洁剂 |
| pH | 1 | 3 | 7 | 9 | 12 |
(1)上述五种物种中,呈中性的是 .
(2)水壶中的水垢,其主要成分为碳酸钙和氢氧化镁,用白醋 (填“能”或“不能”)将它去除.
(3)生活中用洗涤剂清洗餐具上的油污,这种现象属于 (填“溶解”或“乳化”).
(4)厕所清洁剂和白醋相比较,酸性较弱的是 ;厕所清洁剂与炉具清洁剂 (填“能”或“不能”)混合使用.
(7分)实验课上,小舟同学向盛有澄清石灰水的烧杯中加入过量的碳酸钠溶液,生成白色沉淀,过滤后得到无色溶液,他说:“我制得了氢氧化钠溶液!”
(1)小帆同学却说:“这种无色溶液中不一定含有氢氧化钠”他做了如下实验
| 实验步骤 | 实验现象 | 实验结论 |
| 用试管取无色溶液少许,滴入2滴无色酚酞试液 | 无色酚酞试液变红 | 无色溶液中含有氢氧化钠 |
。
(2)小玉设计了另一个实验:
| 实验步骤 | 实验现象 | 实验结论 |
| ①取少量样品于试管中,加入 ②过滤,向滤液中滴加几滴硫酸铜溶液 | ③ ④ | 无色溶液中确实含有氢氧化钠 |
② 。


