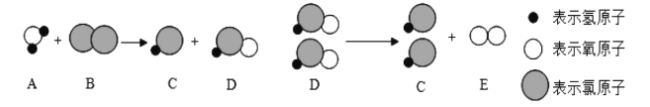
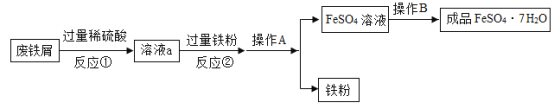
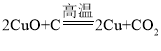题目内容
【题目】在探究酸和碱的化学性质时,同学们准备了四支试管,分别装入如下图所示的物质,然后加入相应的物质进行实验。回答下列问题。
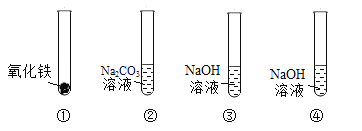
(1)小玉向试管①中加入稀硫酸后观察到的现象是_____,发生反应的化学方程式为_____。
(2)小刚向试管②中滴加稀盐酸后,发现试管中产生无色气泡。小刚对反应后试管中溶液的溶质成分产生了好奇,经过思考后,他提出以下猜想:
I.只含有NaCl
II. NaCl和HCl
III. NaCl和Na2 CO3
IV. NaCl、HCl和Na2CO3
小明认为小刚的猜想_____不合理,理由是_____。
(3)小红向试管③中加入稀盐酸后,没有观察到明显现象。为了证明NaOH溶液能够和稀盐酸发生化学反应,小红提出,可以先向装有NaOH溶液的试管中滴加几滴_____,再加入足量的稀盐酸,就可以观察到_____,从而证明二者发生了化学反应。
(4)小兰向试管④中通入CO2,一段时间后也没有观察到明显现象。她又向试管④中滴加几滴稀盐酸,也没有观察到有气泡产生。于是她得出结论,NaOH溶液与CO2不反应。但是小强不同意小兰的结论,小强的理由是_____。
【答案】红棕色固体逐渐溶解,溶液变成黄色 ![]() IV HCl和Na2CO3能够发生反应,不会共存 无色酚酞溶夜 溶液由红色变成无色 若溶液中的NaOH有剩余,滴入少量的稀盐酸,稀盐酸会先与NaOH反应,就不会观察到有气泡产生
IV HCl和Na2CO3能够发生反应,不会共存 无色酚酞溶夜 溶液由红色变成无色 若溶液中的NaOH有剩余,滴入少量的稀盐酸,稀盐酸会先与NaOH反应,就不会观察到有气泡产生
【解析】
(1)氧化铁会与稀硫酸反应生成易溶于水的硫酸铁,而硫酸铁的溶液显黄色,因此观察到的现象为红棕色固体逐渐溶解,溶液变为黄色,反应的化学方程式为![]() 。
。
(2)HCl 和Na2CO3反应生成NaCl、H2O和CO2气体。因此溶液中一定有NaCl,反应物还可能剩余,所以还可能含有HCI或Na2CO3。但HCl和Na2CO3能够发生反应,不会共存,所以猜测IV不合理。
(3)当酸碱中和反应没有明显现象时,可借助酸碱指示剂的颜色变化等来判断反应是否发生。先向装有NaOH溶液的试管中滴加几滴无色酚酞溶液,溶液会变成红色,再加入过量的稀盐酸,当NaOH被中和后,溶液不再显碱性,溶液的红色会褪去,从而证明者发生 了化学反应。
(4)CO2与NaOH 溶液反应生成易溶于水的Na2CO3,观察不到明显的现象。若溶液中含有剩余的NaOH,即溶液中含有NaOH和Na2CO3两种溶质,滴入少量的稀盐酸,稀盐酸会先与NaOH反应,就不会观察到有气泡产生。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对氯酸钾分解速率的影响,甲设计以下对比实验:
编号 | 实验药品 | 分解温度(°C) |
Ⅰ | 3.0gKC1O3与1.0gMnO2均匀混合加热 | 150 |
Ⅱ | xg KC1O3与 1. 0g CuO均匀混合加热 | 170 |
Ⅰ中反应的化学方程式是_____________________________。
Ⅱ中x的值应为_____________________________。
[实验结论]实验 所用两种金属氧化物中,催化效果最好的是_____________________________。
(2)乙探究了影响双氧水分解速率的某种因素,实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0 g | 1% | 0.1 g | 9 mL |
Ⅱ | 50.0 g | 2% | 0.1 g | 16mL |
Ⅲ | 50.0 g | 4% | 0.1 g | 31mL |
本实验中,测量O2体积的装置是__________________________________________(填编号)。
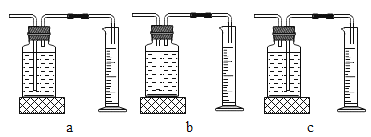
[实验结论]在相同条件下,_____________________________,双氧水分解得越快。/span>
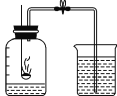
[反思]丙用如图装置进行实验:
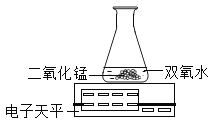
通过比较_____________________________也能达到实验目的。
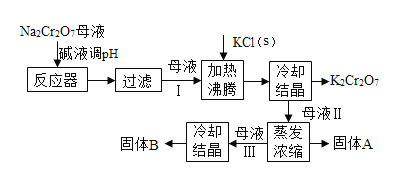
【题目】工业上用重铬酸钠(Na2Cr2O7)结晶后的母液(含少量杂质Fe3+)生产重铬酸钾(K2Cr2O7),其生产流程和相关物质的溶解度曲线及溶解度数据如图(假设流程中反应恰好完全进行):
物质 | 溶解度(g/100g H2O) | ||
0℃ | 40℃ | 80℃ | |
KCl | 28 | 40.1 | 51.3 |
NaCl | 35.7 | 36.4 | 38 |
K2Cr2O7 | 4.7 | 26.3 | 73 |
Na2Cr2O7 | 163 | 215 | 376 |
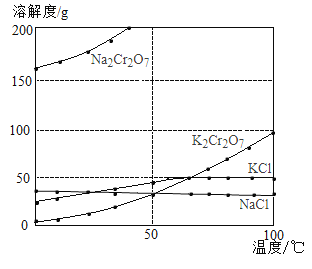
(1)由溶解度曲线可知,50℃时,K2Cr2O7、KCl、NaCl三种物质溶解度的大小关系为_____________,100℃时,用等质量的K2Cr2O7、KCl、NaCl三种固体配制成饱和溶液,溶液质量大小关系为_____________。
(2)将40℃四种物质的饱和溶液降温至0℃,溶质质量分数最小的是______________。
(3)加碱液调节pH的目的是____________。
(4)加入氯化钾固体后,反应的化学方程式为___________。根据溶解度数据可知,该反应能够发生的原因是____________。
(5)流程中要得到母液Ⅲ和固体A的操作为___________,蒸发浓缩原因是___________。