题目内容
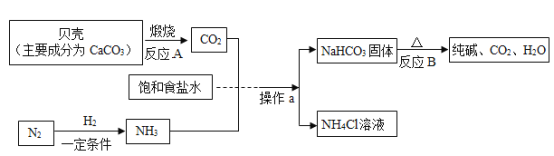
【题目】下图中ABCD分别为不同类别的无机化合物,其中B是一种常见的食品干燥剂,C、 E属于同类物质,F的溶液为黄色且能与硝酸银溶液反应,产生不溶于稀硝酸的白色沉淀。(“→”表示物质之间的相互转化关系,“一”表示两端的物质能发生化学反应)

(1)根据推断写出以下两种物质的化学式:A:____________;F:_____________。
(2) D与C的反应属于____________反应(填基本反应类型)。
(3)写出反应C→E的化学方程式:__________________________。
(4)写出D物质的一种用途__________________________。
(5) E溶液与F溶液反应的现象是__________________________。
【答案】CaCO3 FeCl3 复分解 ![]() 金属除锈(合理均可) 有红褐色沉淀生成,溶液由黄色变为无色
金属除锈(合理均可) 有红褐色沉淀生成,溶液由黄色变为无色
【解析】
如图是初中化学常见的物质A~F相互间的关系,其中B是一种常见的食品干燥剂,所以B是氧化钙,A高温会生成氧化钙,所以A是碳酸钙,氧化钙和水反应生成氢氧化钙,所以C是氢氧化钙,C、E属于同类物质,氢氧化钙会转化成E,所以E是氢氧化钠,F的溶液为黄色且能与硝酸银溶液反应,产生不溶于稀硝酸的白色沉淀,所以F是氯化铁,D会转化成氯化铁,会与碳酸钙反应,所以D是盐酸,经过验证,推断正确。
(1)由分析可知:A是CaCO3,F是FeCl3;故填:CaCO3;FeCl3;
(2)D与C的反应是盐酸和氢氧化钙反应生成氯化钙和水,该反应是两种化合物交换成分生成两种新化合物的反应,属于复分解反应。故填:复分解;
(3)C→E的反应是氢氧化钙和碳酸钠反应生成碳酸钙沉淀和氢氧化钠,化学方程式为:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;故填:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH;
(4)D物质是稀盐酸,稀盐酸可以用来金属除锈。故填:金属除锈(合理均可);
(5)E与F反应是氢氧化钠和氯化铁反应生成氢氧化铁红褐色沉淀和氯化钠,现象是:有红褐色沉淀生成,溶液由黄色变为无色。故填:有红褐色沉淀生成,溶液由黄色变为无色。

 阅读快车系列答案
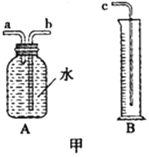
阅读快车系列答案【题目】小敏研究影响锌与盐酸反应快慢的因素。
序号 | 盐酸溶液浓度 | 2分钟内产生氢气的体积 |
1 | 5% | 10mL |
2 | 15% | 28mL |
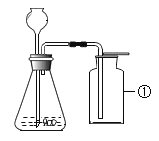
(1)图甲中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的_____管接c。
(2)他选用2克完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过______来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是:________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速度并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此作出猜想:锌与盐酸反应快慢还与_______有关。