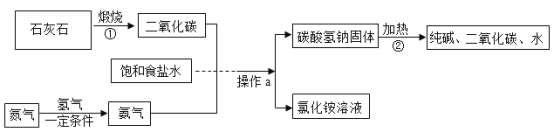
题目内容
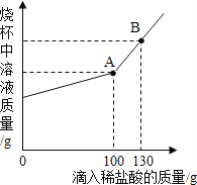
【题目】侯氏制碱法生产的碳酸钠中常含有少量的氯化钠。现有碳酸钠和氯化钠的混合物样品12.5g,将其放入干净的烧杯中,加入100g水,使其完全溶解。向所得溶液中加入溶质质量分数为7.3%的稀盐酸,烧杯中溶液的质量与加入稀盐酸的质量关系曲线如图所示。请回答下列问题。
(1)B点时,烧杯中溶液里存在的粒子为______(填写粒子符号)。
(2)A点时,求此温度下所得不饱和溶液中溶质的质量______。(写出具体计算过程,计算结果精确至0.1g)。
【答案】H2O、Na+、H+和Cl- 13.6g
【解析】
(1)碳酸钠和稀盐酸反应生成氯化钠、二氧化碳和水,溶液质量增加,碳酸钠完全反应后,不再生成二氧化碳气体,继续加入稀盐酸,溶液质量增加幅度增大;
(2)根据反应的HCl的质量和对应的化学方程式求算生成的氯化钠的质量以及参加反应的碳酸钠的质量,进而求算溶质的总质量。
(1)由于曲线在A点有拐点,所以此时是恰好完全反应,所以B点是盐酸有剩余,此时溶液中含有水、氯化钠和氯化氢,所以烧杯中的粒子有水分子、钠离子和氯离子和氢离子。
(2)与碳酸钠反应的HCl的质量为100g×7.3%=7.3g。
设碳酸钠的质量为x,生成的氯化钠的质量为y
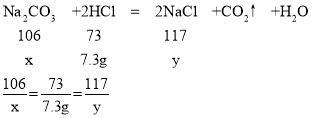
x=10.6g
y=11.7g
A点时,所得不饱和溶液中溶质的质量为12.5g-10.6g+11.7g=13.6g
答:A点时,所得不饱和溶液中溶质的质量为13.6g。
故答案为:(1)H2O、Na+、H+和Cl-;(2)13.6g.

练习册系列答案
相关题目