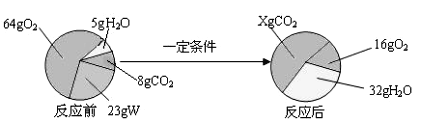
题目内容
【题目】第一组同学就“空气中的氧气”进行如下探究:
(1)定性角度
举例证明空气中含有氧气:___________(写一条)。
(2)定量角度
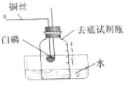
小组同学进行如图所示实验:将装有足量铁丝的量筒倒扣于水槽中,量筒内液面处于9.0 mL的刻度处;放置一周后,可观察到铁丝变________色,同时量筒内的液面上升到约_________mL刻度处,测得空气中氧气所占的体积分数。
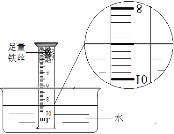
【答案】可燃物在空气中燃烧(合理即可) 红棕色 7.2
【解析】
(1)可燃物在空气中燃烧证明空气中含有氧气;
(2)将装有足量铁丝的量筒倒扣于水槽中,量筒内液面处于9.0mL的刻度处;放置一周后,可观察到铁丝变红棕色,由于氧气约占空气体积的五分之一,因此同时量筒内的液面上升到约9.0mL-9.0mL×![]() =7.2mL刻度处。
=7.2mL刻度处。

 一课一练课时达标系列答案
一课一练课时达标系列答案【题目】将一小块银白色的金属钠放置在空气中会发生下列变化:
![]()
(提出问题)常温下钠与氧气反应,产物有哪些?
(查阅资料)钠的氧化物,除氧化钠(Na2O)外还有过氧化钠(Na2O2),氧化钠与过氧化钠都能与水发生反应,方程式如下:Na2O+H2O=2NaOH;2Na2O2+2H2O=4NaOH+O2↑
(作出猜想)常温下钠与氧气反应的产物。
猜想1:Na2O; 猜想2:Na2O2; 猜想3:_______。
(实验探究一)
实验操作 | 实验现象 | 实验结论 |
取少量钠的氧化物加入足量蒸馏水 | (_____) | 猜想1正确 |
(继续探究)钠在空气中放置一段时间得到白色固体的成分
(作出猜想)猜想一:Na2CO3猜想二:Na2CO3和NaOH
(实验探究二)
实验操作 | 实验现象 | 实验结论 |
1.取少量白色固体加入足量_____。 | 产生白色沉淀 | 白色固体成分为Na2CO3和NaOH |
2.过滤、取少量滤液加入酚酞。 | (______) |
(实验反思)
(1)类比氧化铁与盐酸的反应,写出氧化钠与盐酸反应的化学方程式_______;
(2)过氧化钠也能与盐酸反应,方程式为:2Na2O2+4HCl=4NaCl+2H2O+X,X的化学式为______;
(3)能与酸反应只生成盐和水的氧化物称为碱性氧化物,请判断Na2O2___碱性氧化物(填“是”或“不是”)。
【题目】某实验小组用氯酸钾和二氧化锰混合加热制取氧气时,发现制得的气体有刺激性气味,于是对该气体成分进行探究
(提出问题)氯酸钾与氧化锰混合加热后产生的气体成分是什么?
(查阅资料)
(1)氯酸钾与二氧化锰混合加热产生的气体只以单质形式存在;
(2)氯气(C12)的性质:
①有剌激性气味的气体;②溶于水;③能使湿润的淀粉碘化钾试纸变蓝。
(猜想与假设)
猜想一:该气体为O2;猜想二,该气体为Cl2;猜想三:该气体为________________________。
(实验探究)
序号 | 实验操作 | 实验现象 | 实验结论 |
1 | 小丽用排水集气法收集A、B两瓶气体,将带火星木条伸入A中,湿的淀粉碘化钾试纸伸入B中 | A中带火星木条复燃,B中淀粉碘化钾试纸不变色 | 猜想____________成立 |
2 | 小岚向上排空气法收集C、D两瓶气体,将带火星木条伸入C中,湿润的淀粉碘化钾试纸伸入D中 | C中带火星木条复燃,D中淀粉碘化钾试纸______。 | 猜想三成立 |
(反思与评价)
小涛认为小丽的结论不正确,原因是_____________________。
(拓展应用)
实验室通常用MnO2与浓盐酸共热制取Cl2,请完成该反应的化学方程式MnO2+4HCl(浓)![]() MnCl2 +____________ +Cl2↑
MnCl2 +____________ +Cl2↑