题目内容
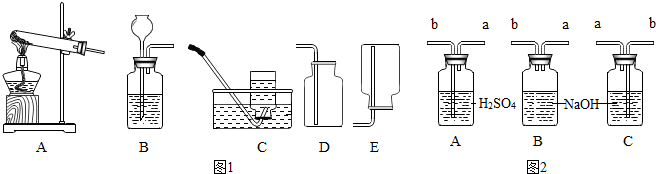
 为研究某含C、H、O元素的有机物的组成,将8.00g该有机物在氧气中充分燃烧,并将生成物全部通过如图的装置,测得下表的结果.(提示:氯化钙是干燥剂)
为研究某含C、H、O元素的有机物的组成,将8.00g该有机物在氧气中充分燃烧,并将生成物全部通过如图的装置,测得下表的结果.(提示:氯化钙是干燥剂)| 实验前 | 实验后 | |
| CaCl2固体+U形管 | 54.28g | 63.28g |
| NaOH+洗气瓶 | 111.20g | 122.20g |
②该有机物中C元素的质量分数;
③该有机物的化学式(最简式).
考点:质量守恒定律及其应用,常见气体的检验与除杂方法,元素的质量分数计算
专题:实验性简答题
分析:反应后U形管质量增加的部分是反应生成水的质量;
反应后洗气瓶质量增加的部分是反应生成二氧化碳的质量;
根据质量守恒定律可以计算参加反应的氧气的质量,进一步可以计算该有机物中C元素的质量分数,从而可以判断该物质的化学式.
反应后洗气瓶质量增加的部分是反应生成二氧化碳的质量;
根据质量守恒定律可以计算参加反应的氧气的质量,进一步可以计算该有机物中C元素的质量分数,从而可以判断该物质的化学式.
解答:解:①反应生成的水的质量为:63.28g-54.28g=9g,
反应生成二氧化碳的质量为:122.20g-111.20g=11g,
参加反应的氧气质量为:9g+11g-8.00g=12g,
该有机物所含碳元素的质量为:11g×
×100%=3g,
氢元素的质量为:9g×
×100%=1g,
氧元素的质量为:(11g-3g)+(9g-1g)-12g=4g,
答:该物质中碳元素、氢元素、氧元素的质量分别是3g、1g和4g.
②该有机物中C元素的质量分数为:
×100%=37.5%,
答:该有机物中C元素的质量分数为37.5%.
③设该物质的化学式是CxHyOz,
则有:12x:y:16z=3g:1g:4g,
x:y:z=1:4:1,
该有机物的化学式是CH4O.
答:该有机物的化学式是CH4O.
反应生成二氧化碳的质量为:122.20g-111.20g=11g,
参加反应的氧气质量为:9g+11g-8.00g=12g,
该有机物所含碳元素的质量为:11g×
| 12 |
| 44 |
氢元素的质量为:9g×
| 2 |
| 18 |
氧元素的质量为:(11g-3g)+(9g-1g)-12g=4g,
答:该物质中碳元素、氢元素、氧元素的质量分别是3g、1g和4g.
②该有机物中C元素的质量分数为:
| 3g |
| 8.00g |
答:该有机物中C元素的质量分数为37.5%.
③设该物质的化学式是CxHyOz,
则有:12x:y:16z=3g:1g:4g,
x:y:z=1:4:1,
该有机物的化学式是CH4O.
答:该有机物的化学式是CH4O.
点评:化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、进行相关方面计算的基础.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列关于溶解度的说法正确的是( )
| A、在温度不变时,溶剂量越多,溶质的溶解度越大 |
| B、20℃时,100g氯化钠饱和溶液中溶解了26.5g氯化钠,则20℃时氯化钠的溶解度为26.5g |
| C、搅拌可以使固体物质的溶解度增大 |
| D、20℃时将31.6g硝酸钾放入100g水中,形成硝酸钾的饱和溶液,20℃时,硝酸钾的溶解度为31.6g |
在水蒸发过程中,下列说法正确的是( )
| A、水分子不断运动 |
| B、水分子之间间隔不变 |
| C、水分子分解成氢原子和氧原子 |
| D、水分子可以保持水的物理性质 |