题目内容
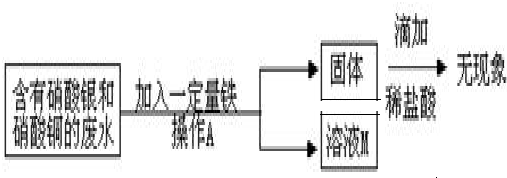
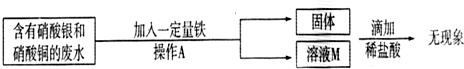
某工厂实验室的废水中含有大量的硝酸银和硝酸铜,某校兴趣小组对其进行了如下研究.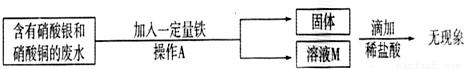
(1)写出加入铁时一定发生反应的化学方程式.
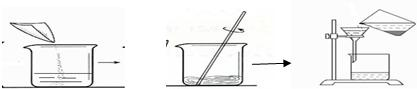
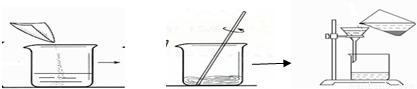
(2)下面图示是回收金属时的一些操,请指出其中的错误

【答案】分析:(1)根据三种金属的活动性铁>铜>银,可判断向硝酸银、硝酸铜的混合溶液中加入铁粉,铁粉能与硝酸银、硝酸铜发生反应,根据反应后所得固体滴加盐酸无现象可判断加入铁粉没有剩余,利用铁粉在混合溶液中先与活动性最弱的金属的盐发生反应,判断加入铁时一定发生反应;
(2)根据基本操作的要求,观察图中所示的操作,指出存在错误的操作.
解答:解:(1)根据三种金属的活动性铁>铜>银,铁能与混合溶液中硝酸银、硝酸铜都发生反应;根据反应后所得固体滴加盐酸无现象可判断加入铁粉没有剩余,利用铁粉在混合溶液中先与活动性最弱的金属银的盐硝酸银发生反应,是否与硝酸铜发生反应不能确定,故加入铁时一定发生反应的化学方程式为Fe+2AgNO3=2Ag+Fe(NO3)2 ;
(2)根据过滤的图示操作可看出,操作中直接把液体倒入漏斗而没有使用玻璃棒进行引流,这种操作是错误的操作;
故答案为:
(1)Fe+2AgNO3=2Ag+Fe(NO3)2 ;
(2)过滤时没用玻璃棒引流.
点评:根据金属活动性的强弱关系,活动性强的金属放入两种活动性弱的金属的混合盐溶液中时,活动性强的金属会先与活动性最弱的金属的盐发生反应.
(2)根据基本操作的要求,观察图中所示的操作,指出存在错误的操作.
解答:解:(1)根据三种金属的活动性铁>铜>银,铁能与混合溶液中硝酸银、硝酸铜都发生反应;根据反应后所得固体滴加盐酸无现象可判断加入铁粉没有剩余,利用铁粉在混合溶液中先与活动性最弱的金属银的盐硝酸银发生反应,是否与硝酸铜发生反应不能确定,故加入铁时一定发生反应的化学方程式为Fe+2AgNO3=2Ag+Fe(NO3)2 ;
(2)根据过滤的图示操作可看出,操作中直接把液体倒入漏斗而没有使用玻璃棒进行引流,这种操作是错误的操作;
故答案为:
(1)Fe+2AgNO3=2Ag+Fe(NO3)2 ;
(2)过滤时没用玻璃棒引流.
点评:根据金属活动性的强弱关系,活动性强的金属放入两种活动性弱的金属的混合盐溶液中时,活动性强的金属会先与活动性最弱的金属的盐发生反应.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目