题目内容
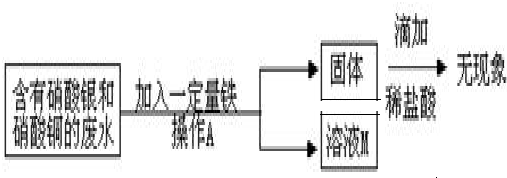
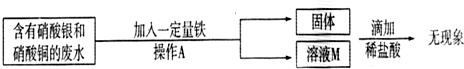
某工厂实验室的废水中含有大量的硝酸银和硝酸铜,某同学想从上述的废液中回收金属银,并得到副产品固体.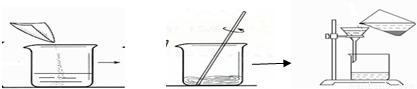
(1)请指出上述实验操作中的错误
(2)写出发生反应的化学方程式 .
【答案】分析:(1)根据基本操作的要求,观察图中所示的操作,指出存在错误的操作;
(2)根据从含有大量的硝酸银和硝酸铜的废液中回收金属银,并得到副产品固体,可推断所得副产品应为硫酸铜,根据金属铜活动性比银强,可采取加入铜粉的方法而达到目的.
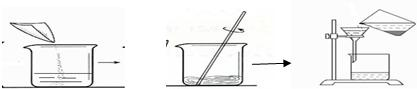
解答:解:(1)根据过滤的图示操作可看出,操作中直接把液体倒入漏斗而没有使用玻璃棒进行引流,这种操作是错误的操作;
(2)向含有大量的硝酸银和硝酸铜的废液中加入适量的铜粉,既回收金属银,通过蒸发可得到副产品固体硫酸铜;反应的化学方程式为Cu+2AgNO3═2Ag+Cu(NO3)2;
故答案为:
(1)过滤时没用玻璃棒引流;
(2)Cu+2AgNO3═2Ag+Cu(NO3)2 .
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来.
(2)根据从含有大量的硝酸银和硝酸铜的废液中回收金属银,并得到副产品固体,可推断所得副产品应为硫酸铜,根据金属铜活动性比银强,可采取加入铜粉的方法而达到目的.
解答:解:(1)根据过滤的图示操作可看出,操作中直接把液体倒入漏斗而没有使用玻璃棒进行引流,这种操作是错误的操作;
(2)向含有大量的硝酸银和硝酸铜的废液中加入适量的铜粉,既回收金属银,通过蒸发可得到副产品固体硫酸铜;反应的化学方程式为Cu+2AgNO3═2Ag+Cu(NO3)2;
故答案为:
(1)过滤时没用玻璃棒引流;
(2)Cu+2AgNO3═2Ag+Cu(NO3)2 .
点评:本题主要考查学生运用所学化学知识综合分析和解决实际问题的能力,活动性强的金属能将活动性弱的金属从其盐溶液中置换出来.

练习册系列答案
相关题目