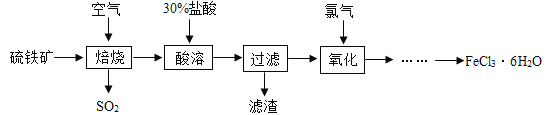
题目内容
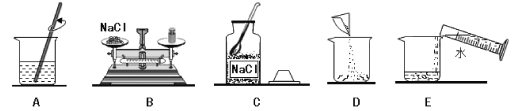
【题目】现有失去标签的4种固体物质,分别是BaCl2、BaCO3、Na2CO3和NaHSO4。
(1)在仅提供蒸馏水和所需仪器的条件下,鉴别出上述4种固体物质。
①最先鉴别出来的固体物质是_____。
②利用①中鉴别出来的物质又可直接鉴别出的固体物质是_____,依据的实验现象是_____。
③利用②中鉴别出来的物质即可鉴别出其它物质。
(2)用鉴别出来的物质进行实验:向Na2CO3溶液中滴入BaCl2溶液至恰好完全反应。
①观察到的实验现象是_____。
②下图表示该反应前后溶液中存在的主要离子,写出以下图形代表的离子(填离子符号):
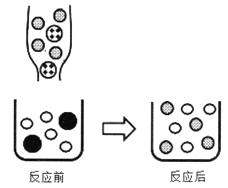
![]() _____
_____![]() _____
_____![]() _____
_____
【答案】BaCO3 NaHSO4 有气泡产生 产生白色沉淀 Cl- Na+ CO32-
【解析】
(1)①NaHSO4、Na2CO3、BaCl2、BaCO3固体四种物质中只有碳酸钡不溶于水,将四种物质分别加入水,不能形成溶液的是碳酸钡,所以最先检验出来的固体物质是碳酸钡;
②由于NaHSO4在水中会解离出Na+、H+、SO42-其中能组合成硫酸,硫酸能与碳酸钡反应生成硫酸钡沉淀、水和二氧化碳,所以有气体放出的是硫酸氢钠, 所以利用它又可直接检验出的固体物质是硫酸氢钠;
(2)①向Na2CO3溶液中滴入BaCl2溶液至恰好完全反应生成碳酸钡沉淀和氯化钠,观察到的实验现象是产生白色沉淀;
②向Na2CO3溶液中滴入BaCl2溶液至恰好完全反应生成碳酸钡沉淀和氯化钠,反应的实质是碳酸根离子与钡离子产生碳酸钡沉淀,氯离子与钠离子在反应过程中不变。![]() 表示氯化钡溶液中反应后溶液中存在的氯离子,离子符号为:Cl-;
表示氯化钡溶液中反应后溶液中存在的氯离子,离子符号为:Cl-;![]() 表示碳酸钠溶液中反应后溶液中存在的钠离子,离子符号为Na+:Na+;
表示碳酸钠溶液中反应后溶液中存在的钠离子,离子符号为Na+:Na+;![]() 碳酸钠溶液中的碳酸根离子,离子符号为:CO32-。
碳酸钠溶液中的碳酸根离子,离子符号为:CO32-。

 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案