题目内容
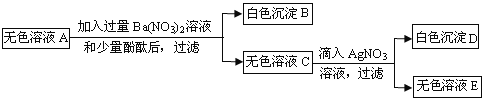
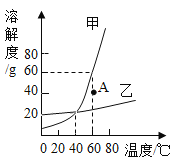
【题目】如图所示,在甲、乙、丙、丁四个盛有100g水的烧杯中,分别放入KNO3固体,充分溶解。下列关于甲、乙、丙、丁所得溶液的说法正确的是( )
温度℃ | t1 | t2 |
KNO3的溶解度(g/100g水) | 60 | 90 |
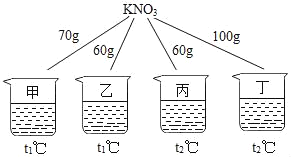
A. 溶液质量:乙=丙<甲<丁
B. 甲、乙、丙、丁均为饱和溶液
C. 将甲升温至t2℃,溶液质量增加
D. 将丁降温至t1℃,没有固体析出
【答案】C
【解析】
A、溶剂质量相同而甲、乙、丙、丁四种溶液中溶质质量的大小关系为丙>乙>甲>丁,所以20℃时四种物质溶解度的关系为:丙>乙>甲>丁,故错误;
B、丙物质未溶解固体的质量为0可知丙溶液可能为饱和溶液,也可能为不饱和溶液,故错误;
B、t1℃硝酸钾的溶解度为60g,t2℃硝酸钾的溶解度为90g,将甲升温至t2℃,溶液质量增加,故正确;
C、t2℃硝酸钾的溶解度为90g,将丁降温至t1℃,可能有固体析,故错误;
故选:C。

【题目】(实验回顾)在烧杯中加入约 5mL 稀氢氧化钠溶液,滴入几滴酚酞溶液。用滴 管慢慢滴入稀盐酸,并不断搅拌。
(1)该实验证明了盐酸和 NaOH 溶液能发生化学反应,依据的现象是_____。
(2)反应的化学方程式为_____。
(探究活动 1)通过证明有水生成来证明酸和碱之间反应的发生。
(查阅资料)a.变色硅胶吸水后由蓝色变为红色;b.无水醋酸是一种酸,常温下为无色液体。
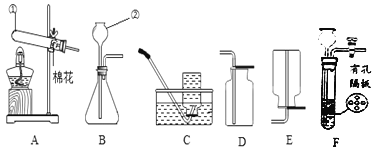
(设计实验)取变色硅胶、无水醋酸和氢氧化钠固体进行如图 1 所示的实验。
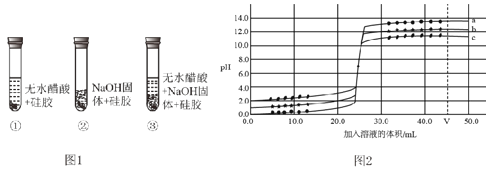
(1)加入试剂后,要迅速塞紧橡胶塞的原因是 _____。
(2)上述实验中能证明酸和碱反应有水生成的现象是_____。
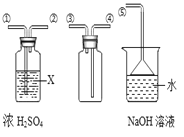
(探究活动 2)通过 pH 变化来证明酸和碱之间反应的发生。图 2 为三种不同浓度的氢氧化 钠溶液与对应浓度盐酸反应的曲线。
(1)该实验是_____(填字母)。
A 将盐酸加入氢氧化钠溶液中 B 将氢氧化钠溶液加入盐酸中
(2)三条曲线所示实验中,所用盐酸浓度最大的是_____(填“a”、“b”或“c”)。
(3)加入溶液体积为 VmL 时,所得溶液中溶质是_____(写化学式)。
(拓展延伸)某同学查阅资料得知常温下 pH 与溶液中 H+浓度有如下关系:
H+浓度(单位略) | 0.1 | 0.01 | 0.001 | 0.0001 | … |
pH | 1 | 2 | 3 | 4 | … |
(1)pH=6 时溶液中 H+的浓度为_____。
(2)下列说法正确的是_____(填字母)。
A H+浓度越大,pH 越小
B pH=1 的盐酸与 pH=3 的盐酸混合后,所得溶液 pH 为 2
C 测定盐酸的 pH 时,先将 pH 试纸用水润湿,再将待测液滴在 pH 试纸上
D 向两份相同的稀盐酸中分别加等体积的水和氢氧化钠溶液,溶液 pH 增大程度相同
(3)推测将 pH=5 的盐酸加水稀释至 1000 倍时,溶液的 pH_____(填字母)。
A 等于 6 B 等于 7 C 等于 8 D 以上都不对