题目内容
(6分)某化学小组同学利用以下三组装置探究燃烧条件。
图1 图2 图3
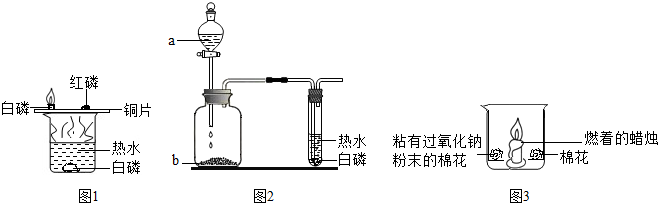
(1)如图1所示,能燃烧的物质是 (填字母序号),燃烧反应的化学方程式为 。
A.水中的白磷 B.铜片上的白磷 C.铜片上的红磷
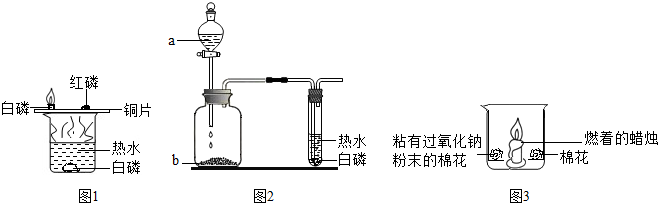
(2)如图2所示,将液体a滴入瓶中并与固体b接触,能观察到白磷燃烧,则瓶内发生反应的化学方程式为 。
(3)如图3所示,在空气中放置时,两团棉花均不燃烧;若将足量二氧化碳倒入烧杯时,可以观察到的现象有:① ;②粘有过氧化钠的棉花燃烧;③未粘有过氧化钠的棉花不燃烧。通过上述实验的对比分析,写出产生现象②的原因 。
完成三组实验之后,同学成功探究出了燃烧所需要的条件。
(1)B 4P+5O2  2P2O5 (2)2H2O2
2P2O5 (2)2H2O2 2H2O + O2↑
2H2O + O2↑
(3)蜡烛的火焰熄灭
过氧化钠与二氧化碳反应时生成氧气,并放出热量(2分,错答、漏答均为0分)
解析试题分析:(1)根据燃烧的条件分析,可燃物燃烧的条件是温度达到着火点,并与氧气接触;图1中铜片上的红磷不能燃烧,是因为温度不能达到它的着火点(240℃);水中的白磷不能燃烧,是因为不能与氧气接触;只有铜片上的白磷能够燃烧,因为即到达了着火点(40℃),又与氧气接触,白磷燃烧生成五氧化二磷,故燃烧反应的化学方程式为4P+5O2  2P2O5 ;
2P2O5 ;
(2)热水中的白磷能够燃烧,说明生成的气体是氧气,那么a是过氧化氢溶液,b是二氧化锰,则瓶内发生反应的化学方程式为2H2O2 2H2O + O2↑;
2H2O + O2↑;
(3)由于二氧化碳不可燃,也不支持燃烧,所以将足量二氧化碳倒入烧杯时,蜡烛的火焰熄灭;由于过氧化钠与二氧化碳能反应,生成碳酸钠和氧气,同时放出热量,所以粘有过氧化钠的棉花满足燃烧的条件,也就能燃烧了。
考点:燃烧与燃烧的条件,书写化学方程式
点评:理解和熟练掌握燃烧的条件、以及二氧化碳的性质,是解答本题的关键,同时还要求学生在学好基础知识的基础上,能够灵活运用知识解决实际问题。

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案