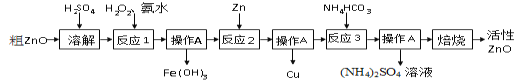
题目内容
【题目】已知A—H均为初中化学常见的物质。其中A、C是组成元素相同的气体,且C能产生温室效应;B为红棕色,是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀。根据右图所示的转化关系(图中反应条件均已略去),请回答:
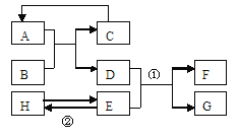
(1)写出下列物质的化学式:B 、C ;
(2)写出下列反应的化学方程式:
① ; ② ,反应②的基本反应类型是 。
【答案】(1)Fe2O3 CO2
(2)①Fe+CuSO4=FeSO4+Cu ② CuSO4+2NaOH =Cu(OH)2↓+Na2SO4 复分解反应
【解析】
试题分析:这是一个框图式的推断题,找到题目的“题眼”,包括特殊的物质颜色,特殊的反应、特殊的现象、特殊的反应条件及常见的三角关系等,此题的“题眼”是C能产生温室效应,可以判断为二氧化碳,A、C是组成元素相同的气体,则A为一氧化碳,B为红棕色,是赤铁矿的主要成分,故B为氧化铁,那么D自然为单质铁,F是紫红色金属,说明为铜,结合H是蓝色沉淀,可以判断E为可溶性的铜盐,如CuSO4、CuCl2等
(1)物质B的化学式Fe2O3,C的化学式:CO2
(2)反应①是单质铁与可溶性铜盐反应,反应的化学方程式:Fe+CuSO4=FeSO4+Cu
反应②是可溶性铜盐生成蓝色沉淀,化学方程式:CuSO4+2NaOH =Cu(OH)2↓+Na2SO4,属于复分解反应

练习册系列答案
相关题目