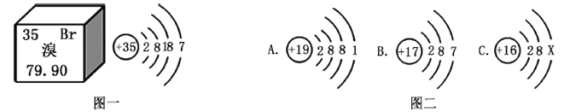
题目内容
【题目】等质量的Mg、Fe、Zn三种金属,分别加入足量的相同质量、相同质量分数的稀硫酸中,其发生反应的质量关系如图所示。读图并判断,下面推论不合理的是( )

①三种金属都能与酸反应
②反应速率:Mg>Fe>Zn
③生成氢气质量:Mg>Fe=Zn
④消耗硫酸的质量:Mg>Fe>Zn
A.②③B.①②C.③④D.①④
【答案】A
【解析】
镁和稀硫酸反应生成硫酸镁和氢气,锌和稀硫酸反应生成硫酸锌和氢气,铁和和稀硫酸反应生成硫酸亚铁和氢气。
①由金属活动性顺序表可知,Mg、Fe、Zn三种金属都能与酸反应,故正确;
②由金属活动性顺序表可知,反应速率Mg>Zn>Fe,故不正确;
③镁、锌、铁和硫酸反应的化学方程式和质量比为
![]()
![]()
![]()
由化学方程式可知,反应生成氢气质量Mg>Fe>Zn,故不正确;
④生成的氢气来自硫酸中的氢,消耗硫酸的质量Mg>Fe>Zn,故正确。
故选A。

练习册系列答案
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案
相关题目