题目内容
【题目】创新能力是现代经济社会发展对学生提出的最迫切要求。如图一是教材探究燃烧的条件的原型实验,图二、图三是某学生的创新实验:
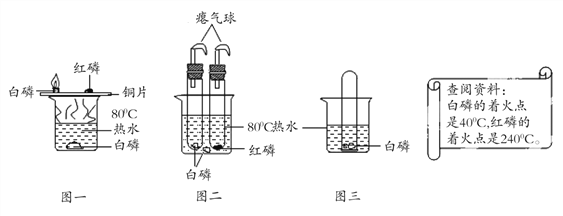
图一中热水在此实验中的作用有下列说法,其中正确的是________________。
①隔绝空气 ②加热使铜片温度升高
A.只有① B.只有② C.是①和②
(2) 欲使图二中的红磷燃烧,可将试管从水中取出,擦干后进行加热;红磷燃烧的化学方程式为_______________。
(3) 将装有某气体的大试管口朝下垂直插入水中,使试管罩住白磷(如图三),结果观察到了“水火相容”的奇观,则大试管所装气体可能是_____________________。
(4) 下列是同学们对该创新实验的判断和评价,你认为合理的是_____________。
A、改进后实验(图二)可防止生成物污染空气,更环保
B、改进后实验(图三)可防止白磷四处移动,实验效果更好
C、图二中气球没有任何作用
【答案】 C  空气或氧气 A、B
空气或氧气 A、B
【解析】本题考查了探究燃烧的条件。
(1)图一中热水在此实验中的作用是隔绝空气,加热使铜片温度升高,故选C;
(2)红磷燃烧生成了五氧化二磷,化学方程式为![]() ;
;
(3)白磷燃烧,说明了满足了白磷燃烧的条件,大试管所装气体可能是空气或氧气;
(4)A、实验(图二)中产生的五氧化二磷,进入到气球中,没有直接排放到空气中。改进后实验(图二)可防止生成物污染空气,更环保,正确;B、实验(图三)中的白磷只能在试管中。改进后实验(图三)可防止白磷四处移动,实验效果更好,正确;C、实验(图二)中产生的五氧化二磷,进入到气球中,没有直接排放到空气中可防止生成物污染空气,更环保,错误。故选AB。

【题目】为了探究金属活动性,同学们将锌和铜分别放入稀硫酸中,锌的表面有气泡产生而铜不反应,写出锌和稀硫酸反应的化学方程式:_____。
老师告诉同学,铜和浓硫酸在加热的条件下也能反应且产生气体。
(提出问题)铜与浓硫酸反应的生成物是什么?其中气体是什么?
(猜想假设)同学们对产生的气体作出了猜想。
猜想一:氢气;
猜想二:二氧化硫;
猜想三:氢气和二氧化硫的混合气体。
同学们作出以上猜想的依据是_____。
(査阅资料)(1)二氧化硫有刺激性气味,会污染空气;
(2)二氧化硫可以使品红溶液褪色,能被氢氧化钾溶液吸收;
(3)浓硫酸具有吸水性,可以干燥气体。
(实验探究)师生设计了如下装置进行实验(部分仪器省略),请完成下列表格。
主要实验步骤 | 主要现象 | 解释或结论 |
①加热装置A一段时间 | 装置B中的现象是_____ | 有二氧化硫生成 |
②点燃装置D处酒精灯 | 装置D玻璃管中无明显现象 | 猜想_____正确 |
③停止加热,将铜丝上提,向装置A中玻璃管鼓入空气 | ||
④冷却,观察A中溶液颜色 | A中液体变为_____色 | 有硫酸铜生成 |
(表达交流)
(1)在步骤③中,鼓入空气的目的是_____。
(2)铜与浓硫酸反应的化学方程式为:Cu+2H2SO4(浓) ![]() CuSO4+SO2↑+_____。
CuSO4+SO2↑+_____。
(反思拓展)
若将装置A中铜丝换成锌片,随着反应的进行,硫酸的浓度逐渐变小,装置D玻璃管中看到的现象是_____。