题目内容
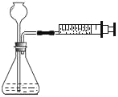
【题目】某同学用如图装置对质量守恒定律进行验证,反应前称出装置连药品总质量,然后将气体内大量大理石倒入锥形瓶中与稀盐酸充分反应后,再称量:
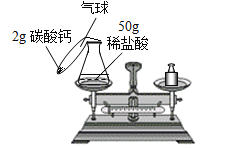
(1)观察到的现象有___________________,天平示数无明显改变,粗略验证了质量守恒定律。
(2)由质量守恒定律可知,化学反应前后,一定改变的是___________,可能改变的是_________。(填序号)。
①原子种类 ②物质种类 ③分子种类 ④元素种类 ⑤原子数目 ⑥物质总质量 ⑦分子数目 ⑧各元素化合价
(3)该同学将锥形瓶口气球取下后,利用该装置测定大理石纯度,称量10.0g样品放入50.0g的锥形瓶中,再加入过量的稀盐酸100g(如图)立即开始记录读数(如图)。回答下列问题:
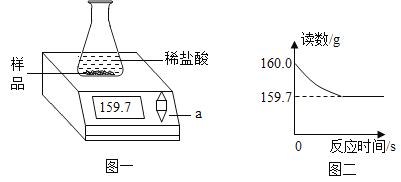
①反应生成二氧化碳的物质的量是__________![]() 。
。
②大理石样品中碳酸钙的质量分数是__________?(保留0.01)根据化学方程式计算。
③反应后锥形瓶中剩余溶液质量为__________克。
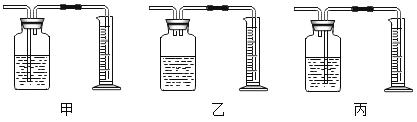
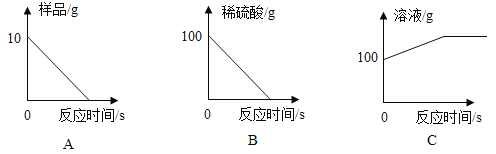
④根据锥形瓶中的反应绘制的下列图像正确的是__________。(填序号)
⑤若实验中逸出的气体质量比理论值偏多,可能的原因是________________。
⑥若实验中逸出的气体质量比理论值偏少,可能的原因是________________。
【答案】气球体积变大 ③② ⑦⑧ 0.0068mol 6.80% 100.38 C ![]() 挥发时,二氧化碳中含有水蒸气
挥发时,二氧化碳中含有水蒸气 ![]() 溶解于水中,未完全逸出
溶解于水中,未完全逸出
【解析】
(1)大理石与稀盐酸反应产生二氧化碳气体,观察到的现象有:气球体积变大,天平示数无明显改变,粗略验证了质量守恒定律。
(2)由质量守恒定律可知,化学反应前后,一定改变的是: ②物质种类 ③分子种类,可能改变的是:⑦分子数目 ⑧各元素化合价;
(3)①反应生成二氧化碳的的质量为160.0g-159.7g=0.3g,则二氧化碳物质的量=![]() ;
;
②解:设参加反应碳酸钙的物质的质量为x

![]() x=0.0068mol ,碳酸钙的质量为=0.068mol×100g/mol=0.68g,则样品中碳酸钙的质量分数=
x=0.0068mol ,碳酸钙的质量为=0.068mol×100g/mol=0.68g,则样品中碳酸钙的质量分数=![]()
③反应后锥形瓶中剩余溶液质量为100g+10g-0.3g-(10g-0.68g)=100.38g
④A、样品中有杂质未反应;故选项错误。
B、稀盐酸有剩余,未完全反应;故选项错误。
C、溶液质量增大,故选项正确;
故选:C。
⑤若实验中逸出的气体质量比理论值偏多,可能的原因是:CO2挥发时,二氧化碳中含有水蒸气;
⑥若实验中逸出的气体质量比理论值偏少,可能的原因是:CO2溶解于水中,未完全逸出。

 名校课堂系列答案
名校课堂系列答案【题目】下表是元素周期表中第2、3周期的元素,请回答有关问题。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
2 | 3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
3 | 11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)下列各组具有相似化学性质的元素是_____(填字母序号);
A Na、Cl B O、S C F、Cl D Cl、Ar
(2)写出一条第三周期元素原子的核外电子排布规律_____;
(3)笫8号元素与笫13号元素的原子形成化合物的化学式为_____;在该化合物中13号元素的化合价为_____;
(4)某粒子的结构示意图为 ,在化学变化中易失2个电子,该粒子的符号为_____。
,在化学变化中易失2个电子,该粒子的符号为_____。