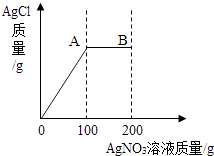
题目内容
【题目】请你参与下列探究: 【问题情景】在课外活动中,小斌按照课本实验(见图1)探究分子的运动时,闻到了刺激性的氨味,于是,小斌在老师的指导下,设计了如图2的实验装置,进行同样的实验,结果不再有刺激性的氨味,并且快速出现实验现象,得到了和课本实验同样的结论.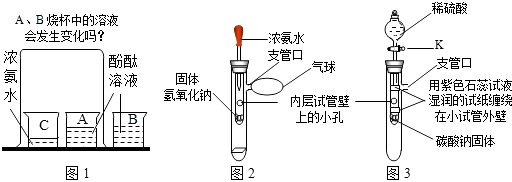
【实验探究与结论】小斌用图2装置进行实验.
(1)滴入少量浓氨水后,湿润的酚酞滤纸条发生的变化是 . 从分子运动的角度分析,此现象可说明的结论是;从浓氨水化学性质的角度分析,此现象可说明的结论是 .
(2)用初中的化学知识分析,固体氢氧化钠的作用是 .
(3)和课本实验比较,小斌改进后的装置的优点是(写出两点)①;② .
(4)【思维拓展】小媚受小斌实验的启发,将图2装置进一步改装成图3装置,用于验证二氧化碳的性质. 打开活塞K滴入稀硫酸后,两条用紫色石蕊试液润湿的试纸发生的相同变化是 , 不同变化是 , 小媚从课本实验中知道,二氧化碳和水本身都不能使石蕊变色,因而她认为以上两个变化验证的二氧化碳的性质依序是、 .
(5)小柔认为小媚的装置还可以同时验证:①二氧化碳能使澄清石灰水变浑浊;②二氧化碳不能燃烧,也不支持燃烧. 小柔为完成自己的两个验证实验,对小媚的实验进行的简单改进是:、
.
【答案】
(1)变红色;分子不断运动;浓氨水能使酚酞变红色
(2)促进氨水受热分解
(3)反应速度快;大大降低了氨气对空气的污染
(4)变红色;下面的先变红色上面的后变红色;能和水反应生成酸;密度比空气密度大
(5)在支管口接上导管通入一个放有燃烧蜡烛的烧杯内;在大试管内装入少量的澄清石灰水
【解析】解:实验探究和结论:(1)通过图示可知,浓氨水通过分子运动可到酚酞溶液中,氨水呈碱性,它能使酚酞变红色,故(1)答案:变红色;分子不断运动;浓氨水能使酚酞变红色.(2)浓氨水中含有水,氢氧化钠溶液与水混合放出大量的热,是分子运动加快,氨水受热易分解为氨气和水,所以答案是:促进氨水受热分解.(3)图2的装置,本身装置是密闭的实验装置,再加上氢氧化钠溶于水放出大量的热的作用,反应速度快,所以答案是:反应速度快、大大降低了氨气对空气的污染.【思维拓展】:(4)二氧化碳密度比空气密度大,二氧化碳能和水反应生成碳酸,碳酸能使紫色石蕊变红色,所以答案是:变红色;下面的先变红色上面的后变红色;能和水反应生成酸;密度比空气密度大.(5)只要使反应生成的二氧化碳与石灰水接触,让它和燃着的蜡烛接触即可,所以答案是:在支管口接上导管通入一个放有燃烧蜡烛的烧杯、在大试管内装入少量的澄清石灰水.
【考点精析】解答此题的关键在于理解二氧化碳的化学性质的相关知识,掌握化学性质:一般情况下不能燃烧,也不支持燃烧,不能供给呼吸;与水反应生成碳酸;能使澄清的石灰水变浑浊;与灼热的碳反应.

 阅读快车系列答案
阅读快车系列答案【题目】某同学为了测定某铜铁混合物中铜的质量分数,先取相同质量的混合物分别置于三个等质量(100g)的烧杯中,再分别加入稀硫酸充分反应,有关实验数据如下:
第1杯 | 第2杯 | 第3杯 | |
混和物质量 | 20g | 20g | 20g |
稀硫酸质量 | 50g | 100g | 150g |
反应后烧杯及其中物质质量 | 169.8g | 219.6g | 269.6g |
请计算:
(1)反应结束后第二个烧杯中产生的气体是克.
(2)混合物中铜的质量分数为多少?
(3)向实验后的第三杯溶液中加入足量的铁粉,完全反应后过滤,将所得的滤液配成10%的FeSO4溶液,需要向滤液中加入多少克水?(假设实验过程中溶液损失忽略不计)